题目内容
10.某同学为研究电化学原理,使用KCl盐桥设计如图所示实验装置.下列分析不合理的是( )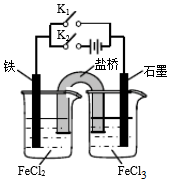
| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |
分析 闭合K1上述装置为原电池装置,铁为负极,铁失电子生成亚铁离子,盐桥中氯子移向左侧烧杯;
闭合K2,为电解池装置,铁为阳极,阳离子移向阴极,据此分析.
解答 解:A.闭合K1断开K2,为原电池,铁为负极,铁失电子生成亚铁离子,亚铁离子浓度增大,盐桥中氯子移向左侧烧杯,氯离子浓度增大,故A正确;
B.闭合K2断开K1,为电解池装置,铁为阳极,阳离子移向阴极,故B错误;
C.闭合K1断开K2,为原电池,铁为负极,电流从正极石墨经外电路流向铁电极,故C正确;
D.闭合K1或闭合K2上述装置分别是原电池和电解池,石墨电极分别为正极和阴极,石墨电极上发生还原反应,发生的反应都是Fe3++e-═Fe2+,故D正确;
故选B.
点评 本题考查了原电池和电解池的工作原理,把握电极反应和电极判断以及电解质溶液变化是解题关键,侧重考查学生的分析能力,题目难度不大.

练习册系列答案
相关题目
20.废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是温度升高,H2O2分解速率加快.
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;.
1.上列各组离子能大量共存的是( )
| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
18.下列有关物质的量的叙述,错误的是( )
| A. | 物质的量是国际单位制中七个基本物理量之一 | |
| B. | 物质的量表示含有一定数目粒子的集体 | |
| C. | 物质的量是国际单位制中的一个基本单位 | |
| D. | 摩尔是计量原子、分子或离子等微观粒子的“物质的量”的单位 |
5.当可逆反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,通入18O2气体,再次达到平衡时18O存在于( )
| A. | SO2、O2、SO3中 | B. | SO3中 | C. | SO2、O2中 | D. | SO2、SO3中 |
15.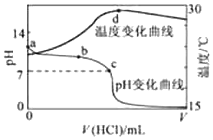 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
2.将6.4gSO2和8.0gSO3相比较,下列结论中错误的是( )
| A. | 它们的体积之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们的分子数目之比为1:1 | D. | 它们所含原子数目之比为3:4 |