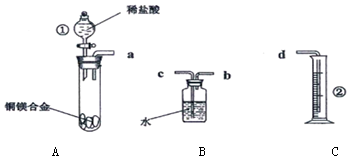
题目内容
12.一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )| A. | 加催化剂,v正、v逆都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数 | |
| C. | 降温,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数 | |
| D. | 增大氮气的浓度,v正增大、v逆不变,N2转化率减小,H2转化率增大 |
分析 A.催化剂同等程度改变化学反应速率,不影响化学平衡;
B.增大压强,正、逆反应速率都增大,平衡向体积减小的方向移动;
C.降低温度,正、逆反应速率都减小,平衡向放热反应方向移动;
D.增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变.
解答 解:A.催化剂能够同等程度改变正逆反应速率,故A正确;
B.加压,气体物质的量大的一边反应速率增大的倍数比气体物质的量小的一边增大倍数大,即v正增大的倍数大于v逆增大的倍数,故B正确;
C.降温,放热反应速率减小倍数小于吸热反应减小倍数,即v正减小的倍数小于v逆减小的倍数,故C错误;
D.增大反应物氮气的浓度,v正增大、v逆不变,平衡正向移动,N2转化率减小,H2转化率增大,故D正确,
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,题目难度中等,本题易错点为D,注意增大氮气的浓度的时刻只改变反应物浓度,此时逆反应速率不变.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
20.废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是温度升高,H2O2分解速率加快.
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;.
4.下列物质置于1L水中充分搅拌后,溶液中阴离子种类最多的是( )
| A. | KCl | B. | Mg(OH)2 | C. | Na2CO3 | D. | MgSO4 |
1.上列各组离子能大量共存的是( )
| A. | Na+、Mg2+、OH-、C1- | B. | Ba2+、K+、CO32-、NO3- | ||
| C. | Na+、K+、C1-、HCO3- | D. | H+、Na+、C1-、OH- |
2.将6.4gSO2和8.0gSO3相比较,下列结论中错误的是( )
| A. | 它们的体积之比为1:1 | B. | 它们所含氧原子数目之比为2:3 | ||
| C. | 它们的分子数目之比为1:1 | D. | 它们所含原子数目之比为3:4 |
 .
.