题目内容
质子交换膜燃料电池广受关注.
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+O2(g)═CO(g)△H1=-110.35kJ?mol-1
2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ?mol-1
H2O(l)═H2O(g)△H3=+44.0kJ?mol-1
则C(s)+H2O(g)═CO(g)+H2(g)△H4= .
(2)燃料气(流速为1800mL?h-1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 .
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为 .
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.

加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好.催化剂为
-HIO3,120℃时,反应1h后CO的体积为 mL.
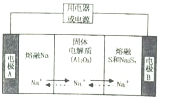
(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为 .
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气.
已知:C(s)+O2(g)═CO(g)△H1=-110.35kJ?mol-1
2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ?mol-1
H2O(l)═H2O(g)△H3=+44.0kJ?mol-1
则C(s)+H2O(g)═CO(g)+H2(g)△H4=
(2)燃料气(流速为1800mL?h-1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除.
①160℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为
②灼烧草酸铈[Ce2(C2O4)3]制得CeO2的化学方程式为
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示.

加入
| CuO |
| CeO2 |
(3)图2为甲酸质子交换膜燃料电池的结构示意图.该装置中
考点:热化学方程式,原电池和电解池的工作原理,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:(1)根据盖斯定律来计算化学反应的焓变;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,配平方程式即可;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象来回答;催化剂为CuO/CeO2-HIO3,120℃时,CO的转化率是80%来计算回答;
(3)在燃料点池中,氢离子移向正极,在负极上发生燃料失电子的氧化反应.
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,配平方程式即可;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象来回答;催化剂为CuO/CeO2-HIO3,120℃时,CO的转化率是80%来计算回答;
(3)在燃料点池中,氢离子移向正极,在负极上发生燃料失电子的氧化反应.
解答:
解:(1)已知:①C(s)+
O2(g)═CO(g)△H1=-110.35kJ?mol-1
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ?mol-1
③H2O(l)═H2O(g)△H3=+44.0kJ?mol-1
则:反应C(s)+H2O(g)═CO(g)+H2(g)可以是①+②×
-③得到,所以△H4=①+②×
-③=(-110.35kJ?mol-1)+(571.6kJ?mol-1)×
-44.0kJ?mol-1
=+131.45kJ/mol,故答案为:+131.45kJ/mol;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳,方程式为2CO+O2
2CO2,故答案为:2CO+O2
2CO2;
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,即Ce2(C2O4)3
2CeO2+4CO↑+2CO2↑,故答案为:Ce2(C2O4)3
2CeO2+4CO↑+2CO2↑;
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象知道当HIO3加入时,催化性能最好,催化剂为CuO/CeO2-,120℃时,CO的转化率是80%,气体混合物流速为1800mL?h-1;体积分数为:0.98%的CO,则反应1小时后CO的体积为
×1800×1×0.98%×80%=3.528,故答案为:HIO3;3.528;
(3)在燃料点池中,氢离子移向正极b极,所以a是负极,在负极上发生燃料失电子的氧化反应:HCOOH-2e-=CO2+2H+,故答案为:a;HCOOH-2e-=CO2+2H+.
| 1 |
| 2 |
②2H2O(l)═2H2(g)+O2(g)△H2=+571.6kJ?mol-1
③H2O(l)═H2O(g)△H3=+44.0kJ?mol-1
则:反应C(s)+H2O(g)═CO(g)+H2(g)可以是①+②×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
=+131.45kJ/mol,故答案为:+131.45kJ/mol;
(2)①160℃、CuO/CeO2作催化剂时,CO优先氧化为二氧化碳,方程式为2CO+O2
| ||
| 160℃ |
| ||
| 160℃ |
②灼烧草酸铈[Ce2(C2O4)3],分解制得CeO2、一氧化碳以及二氧化碳,即Ce2(C2O4)3
| ||
| ||
③CuO/CeO2催化剂催化性能最好,即化学反应速率最快,据图象知道当HIO3加入时,催化性能最好,催化剂为CuO/CeO2-,120℃时,CO的转化率是80%,气体混合物流速为1800mL?h-1;体积分数为:0.98%的CO,则反应1小时后CO的体积为
| 1 |
| 4 |
(3)在燃料点池中,氢离子移向正极b极,所以a是负极,在负极上发生燃料失电子的氧化反应:HCOOH-2e-=CO2+2H+,故答案为:a;HCOOH-2e-=CO2+2H+.
点评:本题目综合考查学生电化学、热化学、盖斯定律的应用等综合知识,注意知识的归纳和整理是关键,难度中等.

练习册系列答案
相关题目
下列叙述不正确的是( )
| A、植物油的不饱和程度高于动物油,植物油更易氧化变质 |
| B、除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 |
| C、过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:1 |
| D、向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液不一定含有CO32- |
室温下向10mL pH=3的醋酸溶液中加水稀释后,下对说法正确的是( )
| A、溶液中导电粒子的数目减少? | ||
| B、醋酸的电离程度增大,c(H+)亦增大 | ||
C、溶液中
| ||
| D、再加入10 mL pH=ll的NaOH溶液,混合液的PH=7 |
下列说法中正确的是( )
| A、Na2O和Na2O2组成元素相同,化学性质也完全相同 |
| B、向硫酸铝溶液中逐滴加人过量氢氧化钡溶液,会出现先沉淀后完全溶解的现象 |
| C、等物质的量浓度的NH4Cl和CH3COONH4溶液中的c( NH4+)相等 |
| D、高纯度二氧化硅广泛用于制光导线维,光导纤维遇强碱时会“断路” |
以0.10mol/L的氢氧化钠溶液滴定某一元弱酸(已知其在该条件下的电离度α≈1%)的滴定曲线如图所示.横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH.下列说法正确的是( )


| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
下列说法中正确的是( )
| A、在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的电化学腐蚀 |
| D、外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
NA为阿伏加德罗常数,关于a g亚硫酸钠晶体(Na2SO3?7H2O)的说法中正确的是( )
A、含Na+数目为
| ||
B、含氧原子数目为
| ||
C、完全氧化SO32-时转移电子数目为
| ||
D、含结晶水分子数目为
|
X、Y都是短周期元素,X原子最外层只有一个电子,Y元素最高正价与最低负价的代数和为6,X和Y两元素形成的化合物为R,则下列关于R的叙述正确的是( )
| A、R一定是共价化合物 |
| B、R一定是离子化合物 |
| C、R可能是共价化合物,也可能是离子化合物 |
| D、R可能是气态物质,也可能是固态物质 |
 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用