题目内容
某物质可能含有炭粉、碳酸钙、氧化铜、氧化铁中的一种或几种,现进行如下实验:
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体.
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,同时产生一种可燃性气体.
根据以上实验推断:该固体一定含有 ,一定不含有 ,可能含有 .
(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体.
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,同时产生一种可燃性气体.
根据以上实验推断:该固体一定含有
考点:几组未知物的检验
专题:实验设计题
分析:(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体,即二氧化碳,原物质可以是碳和氧化铁或是碳和氧化铜的混合物,还可以含有碳酸钙;
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,则一定不会有金属铜,同时产生一种可燃性气体氢气,所以一定存在金属铁,所以一定不含CuO,一定含有炭粉、氧化铁.
即该固体一定含有炭粉、氧化铁;一定不含有氧化铜;可能含有碳酸钙.
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,则一定不会有金属铜,同时产生一种可燃性气体氢气,所以一定存在金属铁,所以一定不含CuO,一定含有炭粉、氧化铁.
即该固体一定含有炭粉、氧化铁;一定不含有氧化铜;可能含有碳酸钙.
解答:
解:(1)取样品,加热至高温,产生一种能使澄清石灰水变浑浊的无色气体,即二氧化碳,原物质可以是碳和氧化铁或是碳和氧化铜的混合物,还可以含有碳酸钙;
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,则一定不会有金属铜,同时产生一种可燃性气体氢气,所以一定存在金属铁,所以一定不含CuO,一定含有炭粉、氧化铁.
即该固体一定含有炭粉、氧化铁;一定不含有氧化铜;可能含有碳酸钙.
故答案为:炭粉、氧化铁;氧化铜;碳酸钙.
(2)往冷却后的固体残渣中加入足量的稀盐酸,固体残渣全部溶解,则一定不会有金属铜,同时产生一种可燃性气体氢气,所以一定存在金属铁,所以一定不含CuO,一定含有炭粉、氧化铁.
即该固体一定含有炭粉、氧化铁;一定不含有氧化铜;可能含有碳酸钙.
故答案为:炭粉、氧化铁;氧化铜;碳酸钙.
点评:本题是一道关于物质的鉴别题,注意物质的性质以及实验现象是解题的关键,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、Al2O3固体不导电且不溶于水,它在水溶液中不导,所以Al2O3不是电解质 |
| B、Na2SO4溶液导电,所以Na2SO4溶液是电解质 |
| C、CO2的水溶液可以导电,CO2是电解质 |
| D、1.5mol/L的NaCl溶液与1.0mol/L的MgCl2溶液相比较,导电能力后者强 |
体积为V mL,密度为ρ g?cm3的溶液,含有摩尔质量为M的溶质m g,其物质的量的浓度为c mol?L-1,溶质的质量分数为w%,则下列表达式正确的是( )
A、c=
| ||
B、m=V?ρ
| ||
C、w%=
| ||
D、c=
|
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)?Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |
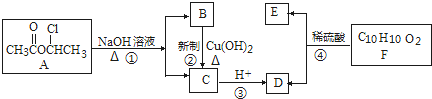
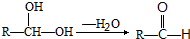 :请回答下列问题:
:请回答下列问题:
