题目内容
硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业生产中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 .
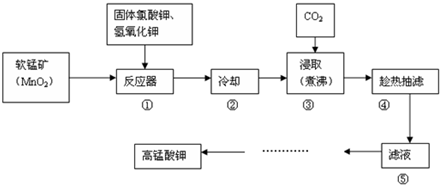
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气中各成分的体积分数分别为:SO2 7%;O2 1l%;N2 82%);
利用表中数据分析.在实际生产中选择的适宜生产条件是:温度 ℃;压强 MPa.
(3)为提高SO3吸收率,实际生产中用 吸收SO3;这样做的优点是 .
(4)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是 (选填序号).
A.保护环境.防止空气污染 B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率 D.防止催化剂中毒.
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气中各成分的体积分数分别为:SO2 7%;O2 1l%;N2 82%);
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(3)为提高SO3吸收率,实际生产中用
(4)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
A.保护环境.防止空气污染 B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率 D.防止催化剂中毒.
考点:工业制取硫酸
专题:元素及其化合物,化学应用
分析:(1)根据题目提供的数据分析二氧化硫催化氧化的适宜条件和原因.从催化剂的催化活性去确定温度的选择,从反应进行程度的大小、设备的耐压性、控制成本等角度考虑;
(2)正确理解影响反应速率的条件和化学平衡移动的条件,催化剂可影响反应速率而不能导致平衡移动;
(3)吸收塔中吸收液的选择从实际吸收效果考虑不采用水而采用浓硫酸,可防止产生酸雾;
(4)硫酸工业尾气中SO2净化处理方法很多,SO2是酸性氧化物,因此常用碱液吸收,如氨水、氢氧化钠溶液、石灰水等.
(2)正确理解影响反应速率的条件和化学平衡移动的条件,催化剂可影响反应速率而不能导致平衡移动;
(3)吸收塔中吸收液的选择从实际吸收效果考虑不采用水而采用浓硫酸,可防止产生酸雾;
(4)硫酸工业尾气中SO2净化处理方法很多,SO2是酸性氧化物,因此常用碱液吸收,如氨水、氢氧化钠溶液、石灰水等.
解答:
解(1)第一步:SO2的制取.主要原料是黄铁矿和空气,在高温下煅烧,使硫元素转变成SO2气体,生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化,故答案为:生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等;
(2)工业上利用2SO2(g)+O2(g)
2SO3(g),△H=-98.3kJ?mol-1反应制备SO3,该反应为可逆反应,
正方向为放热反应,从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃,
故答案为:400℃~500℃;0.1;
(3)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,
故答案为:98%的浓硫酸; 防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率;
(4)A.从沸腾炉中出来的气体,温度较高,进入催化反应室中的热交换装置,对催化剂进行预热,当催化剂达到一定温度时二氧化硫与氧气在催化剂作用下反应,可以充分利用热量,降低生产成本,故A错误;
B.从沸腾炉中出来的气体,温度较高,进入催化反应室中的热交换装置,对催化剂进行预热,当催化剂达到一定温度时二氧化硫与氧气在催化剂作用下反应,同时反应放出的热量一方面维持自身的运行另一方面也可预热进入催化反应室的气体,故B正确;
C.SO2和O2反应生成SO3为放热反应,温度升高促使平衡逆向移动,不会提高SO2的转化率,故C错误;
D.从沸腾炉中出来的气体,含有砷硒化合物,可以导致催化剂中毒,但在进入催化反应室前,先要经过净化、除尘处理,以除去砷硒化合物,所以不会发生催化剂中毒现象,故D错误;
故选B.
(2)工业上利用2SO2(g)+O2(g)
| ||
| 高温高压 |
正方向为放热反应,从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;同时反应中使用催化剂,为了使催化剂的催化活性最强,根据表格中提供的数据应该采用400℃~500℃,
故答案为:400℃~500℃;0.1;
(3)吸收塔中SO3如果用水吸收,发生反应:SO3+H2O═H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻碍水对三氧化硫的吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,最终得到“发烟”硫酸,
故答案为:98%的浓硫酸; 防止吸收过程中产生酸雾,提高SO3吸收率和硫酸的产率;
(4)A.从沸腾炉中出来的气体,温度较高,进入催化反应室中的热交换装置,对催化剂进行预热,当催化剂达到一定温度时二氧化硫与氧气在催化剂作用下反应,可以充分利用热量,降低生产成本,故A错误;
B.从沸腾炉中出来的气体,温度较高,进入催化反应室中的热交换装置,对催化剂进行预热,当催化剂达到一定温度时二氧化硫与氧气在催化剂作用下反应,同时反应放出的热量一方面维持自身的运行另一方面也可预热进入催化反应室的气体,故B正确;
C.SO2和O2反应生成SO3为放热反应,温度升高促使平衡逆向移动,不会提高SO2的转化率,故C错误;
D.从沸腾炉中出来的气体,含有砷硒化合物,可以导致催化剂中毒,但在进入催化反应室前,先要经过净化、除尘处理,以除去砷硒化合物,所以不会发生催化剂中毒现象,故D错误;
故选B.
点评:本题考查工业接触法制硫酸的相关细节,如原料的选择、反应条件的选择、热交换器的作用、工业尾气的处理等内容,只要了解基础知识都能迎刃而解,难度一般.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)?Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |
某溶液中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等,现将该溶液分成4份,分别进行如下实验则下列说法不正确的是( )
①酸化后滴加适量的淀粉KI溶液,呈蓝色;
②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
①酸化后滴加适量的淀粉KI溶液,呈蓝色;
②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;
④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
| A、该溶液中一定含有NO3-、SO42-、NH4+ |
| B、根据实验④可推出溶液中不存在NO2-与SO32- |
| C、往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl- |
| D、根据实验①可推出溶液中含有NO3-或NO2- |
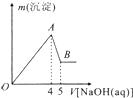 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积的关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )| A、1:1 | B、3:2 |
| C、3:1 | D、6:1 |
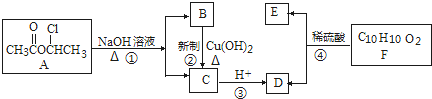
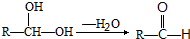 :请回答下列问题:
:请回答下列问题: