题目内容
12.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子组合是( )| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
分析 加入过量的氢氧化钠溶液并充分搅拌,四种金属离子均转化为沉淀,然后氢氧化铝转化为偏铝酸根离子,氢氧化亚铁被氧化为氢氧化铁,结合再加入过量的盐酸发生的反应解答.
解答 解:溶液中有Fe2+、Fe3+、Mg2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液并充分搅拌,
反应时,四种金属离子均先转化为沉淀,然后氢氧化铝与过量的NaOH反应转化为偏铝酸根离子,氢氧化亚铁被氧化为氢氧化铁,
再加入过量的盐酸,氢氧化铁、氢氧化镁、偏铝酸钠与盐酸反应生成金属阳离子为Fe3+、Mg2+和Al3+,
显然溶液中大量减少的离子是Fe2+,
故选C.
点评 本题考查离子的共存,为高考常见题型,侧重复分解反应的考查,把握发生的化学反应为解答的关键,注意氢氧化铝的两性、氧化还原反应即可解答,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
2.下列物质属于纯净物的是( )
| A. | 氢氧化铁胶体 | B. | 碘酒 | C. | 胆矾(CuSO4•5H2O ) | D. | 生铁 |
20.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
| A. | v(NO)=0.0010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NH3)=0.0100mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
7.下列反应中,属于取代反应的是( )
| A. | 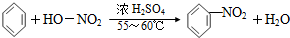 | |
| B. |  | |
| C. | 2 CH3CH2OH+O2 $→_{△}^{催化剂}$ 2 CH3CHO+2 H2O | |
| D. | CH2=CH2+HCl→CH3CH2Cl |
17.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.8gD2O 分子中含有的质子数为 NA | |
| B. | 常温下,7.8gNa2O2中含有的阴离子个数为 0.1NA | |
| C. | 标准状况下,11.2L 18O2中所含中子数为 8NA | |
| D. | 25℃时,2.24 LCO2分子中共用电子对数目为 0.4NA |
4.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在 100kPa 时,含 1mol 碳原子的石墨转化为金刚石,要吸收 1.895kJ 的热量.据此试判断下列结论正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 石墨比金刚石稳定 | |
| C. | 含 1mol 碳原子的石墨比含 1mol 碳原子的金刚石总能量高 | |
| D. | 石墨和金刚石互为同位素 |
1.下列有关说法正确的是( )
| A. | 因为 H-F 的键能大于 H-Cl,所以 HF 沸点高于 HCl | |
| B. | SO3是由极性键构成的非极性分子 | |
| C. | 氯化钠和氯化铯晶体中氯离子的配位数相同 | |
| D. | 第一电离能大小比较 Br>Se>As |