题目内容
6.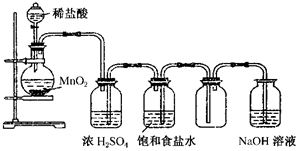 如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.(1)指出图中的各处错误:
①不能用稀盐酸,而应用浓盐酸;
②应有加热装置,应用酒精灯加热;
③盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒;
④两洗气瓶里进气导管和出气导管的长短不对.
(2)在改过后的装置中,写出下列物质的作用:
①饱和食盐水除去Cl2中的氯化氢;
②浓硫酸除去氯气中的水蒸气;
③NaOH溶液吸收多余的氯气.
(3)在改正过的装置中,制取氯气所发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;NaOH溶液中发生反应的离子方程式:Cl2+2OH-=Cl-+ClO-+2H2O.
分析 实验室用二氧化锰与浓盐酸加热制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,氯气密度大于空气密度,用向上排气法收集,氯气有毒,过量的氯气应用氢氧化钠溶液吸收;
(1)①稀盐酸与二氧化锰不反应;
②用二氧化锰与浓盐酸反应需要加热;
③浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质;
④洗气瓶中进气管应插入液面以下;
(2)浓盐酸易挥发制备的氯气中含有氯化氢和水蒸气,依据氯化氢易溶于水、氯气在饱和食盐水中溶解度不大选择饱和食盐水除去氯化氢,依据浓硫酸具有吸水性选择浓硫酸干燥氯气,氯气有毒,能够与氢氧化钠反应被氢氧化钠吸收,可以用氢氧化钠进行尾气处理;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,据此书写离子方程式.
解答 解:实验室用二氧化锰与浓盐酸加热制备氯气,浓盐酸易挥发,制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水、浓硫酸的洗气瓶除去杂质,氯气密度大于空气密度,用向上排气法收集,氯气有毒,过量的氯气应用氢氧化钠溶液吸收;
(1)指出图中的各处错误:
①不能用稀盐酸,而应用浓盐酸;
②应有加热装置,应用酒精灯加热;
③盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒;
④两洗气瓶里进气导管和出气导管的长短不对;
故答案为:①不能用稀盐酸,而应用浓盐酸;
②应有加热装置,应用酒精灯加热;
③盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒;
④两洗气瓶里进气导管和出气导管的长短不对;
(2)浓盐酸易挥发制备的氯气中含有氯化氢和水蒸气,依据氯化氢易溶于水、氯气在饱和食盐水中溶解度不大选择饱和食盐水除去氯化氢,依据浓硫酸具有吸水性选择浓硫酸干燥氯气,氯气有毒,能够与氢氧化钠反应被氢氧化钠吸收,可以用氢氧化钠进行尾气处理.
所以:①饱和食盐水除去Cl2中的氯化氢;②浓硫酸除去氯气中的水蒸气;③NaOH溶液吸收多余的氯气;
故答案为:①饱和食盐水除去Cl2中的氯化氢;②浓硫酸除去氯气中的水蒸气;③NaOH溶液吸收多余的氯气;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+2H2O;
点评 本题考查了氯气的制备,明确氯气制备原理及性质是解题关键,题目难度不大.

| A. | H2O3?2H++CO32- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | BaOH)2?Ba2++2OH- |
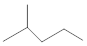 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.(2)
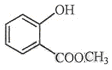 中含氧的官能团的名称为羟基,酯基.
中含氧的官能团的名称为羟基,酯基.(3)戊烷(C5H12)的某种同分异构体只有一种一氯代物,试书写它的结构简式.C(CH3)4.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、稀盐酸(0.5mol•L-1)、稀 NaOH溶液(0.55mol•L-1),尚缺少的实验玻璃用品是环形玻璃搅拌棒、温度计.
(2)写出表示稀盐酸和稀氢氧化钠溶液反应中和热的热化学方程式(中和热为57.3kJ•mol-1):HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1.
(3)若用稀醋酸、稀硫酸、浓硫酸分别和稀氢氧化钠溶液反应来测定中和热,恰好完全反应时对应的热效应分别为△H1、△H2、△H3的大小关系是△H1>△H2>△H3.
(4)每组实验所用氢氧化钠溶液和稀盐酸的体积均为 50mL,可近似认为该实验中稀盐酸和稀氢氧化钠溶液的密度均为 1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),实验中记录数据如表所示,请填写表中空白:
| 编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2-T1/℃ | △H | ||
| 盐酸 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 29.2 | ------- | ------- |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | ||
| 3 | 26.4 | 26.2 | 26.3 | 29.5 | ||
| A. | 减少部分NH4HS固体 | B. | 压强温度不变充入少量Ar | ||
| C. | 容积、温度一定、充入He | D. | 增加部分NH4HS固体 |
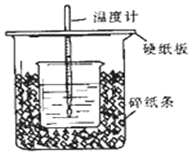 ①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.
①用50mL0.50mol/L盐酸与50mL一定浓度的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称环形玻璃搅拌棒,另一处错误是小烧杯口和大烧杯口没有平齐.