题目内容
18.反应NH4HS(S)?NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使平衡发生移动的是( )| A. | 减少部分NH4HS固体 | B. | 压强温度不变充入少量Ar | ||
| C. | 容积、温度一定、充入He | D. | 增加部分NH4HS固体 |
分析 A、硫氢化铵是固体,其量的增减不影响化学平衡;
B、压强温度一定,充入少量氩气,体积增大,氨气和硫化氢气体的分压减小;
C、充入稀有气体,各组分浓度没有变化,化学平衡不移动;
D、硫氢化铵是固体,其量的增减不影响化学平衡.
解答 解:A、由于硫氢化铵是固体,其量的增减不影响化学平衡移动,故A错误;
B、压强温度一定,充入少量氩气,体积增大,氨气和硫化氢气体的分压减小,平衡正向进行,故B正确;
C、容积、温度一定,充入氦气,各组分的浓度没有发生变化,化学平衡不移动,故C错误;
D、由于硫氢化铵是固体,其量的增减不影响化学平衡移动,故D错误;
故选B.
点评 本题考查了化学平衡的影响因素,注意恒容、恒温体积下充入稀有气体,化学平衡不移动,本题难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
8.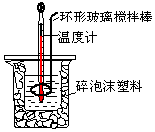 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
(1)在该实验中,量取50mL 盐酸或NaOH 溶液,需要用到的玻璃仪器量简和胶头滴管.
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失.
(3)某同学实验记录的数据如表所示,其中记录的终止温度是指完全反应后混合溶液的最高温度.
(4)计算该实验发生中和反应时放出的热量为1.31kJ(中和后生成的溶液的比热容c=4.18J/(g•℃).
(5)如果用50mL 0.55mol/L的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少.
 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失.
(3)某同学实验记录的数据如表所示,其中记录的终止温度是指完全反应后混合溶液的最高温度.
(4)计算该实验发生中和反应时放出的热量为1.31kJ(中和后生成的溶液的比热容c=4.18J/(g•℃).
(5)如果用50mL 0.55mol/L的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少.
9.如图W、X、Y、Z为四种物质,若箭头表示能一步转化的反应,则符合常温下能实现图示转化关系的是( )
| 选项 | W | X | Y | Z | 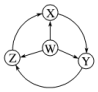 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
3.化学与生活、社会密切相关,下列有关说法中正确的是( )
| A. | 燃煤中加入CaO后可减少酸雨的发生气体的排放 | |
| B. | 纤维素、蛋白质、油脂都是天然有机高分子化合物 | |
| C. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 | |
| D. | 明矾是一种水处理剂,可用于水的杀菌、消毒 |
7.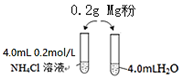 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是因为气温低于25℃时,Kw小于1.0×10-14,纯水的pH略大于7
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气)
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:NH4++H2O?NH3•H2O+H+
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
①上述探究实验1-2选用的盐酸为D(填字母).
A、1mol•L-1 B、pH=1.0 C、0.2mol•L-1 D、pH=5.90
②通过实验对比,说明NH4Cl水解产生的H+对反应影响小于NH4+对反应影响(填“小于”、“大于”或“等于”).
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素.
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂.
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式Mg+2 NH4+=Mg2++2NH3↑+H2↑.
 某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.
某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡.经检验该过程产生两种气体,其中一种气体有刺激性气味.(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是因为气温低于25℃时,Kw小于1.0×10-14,纯水的pH略大于7
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:将湿润的红色石蕊试纸放在试管口看是否变蓝,如果变蓝,则有氨气生成,否则没有氨气生成(或者用蘸有浓盐酸的玻璃棒放在试管口,看是否有白烟生成,如果有白烟生成,则有氨气,否则没有氨气)
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:NH4++H2O?NH3•H2O+H+
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
| 序号 | 实验试剂 | 实验现象 | |
| 实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
| 实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
A、1mol•L-1 B、pH=1.0 C、0.2mol•L-1 D、pH=5.90
②通过实验对比,说明NH4Cl水解产生的H+对反应影响小于NH4+对反应影响(填“小于”、“大于”或“等于”).
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素.
| 实验序号 | 实验试剂 | |
| 实验2-1 | 0.20g镁粉 | 3.0 mL 0.2mol/LNaCl溶液 |
| 实验2-2 | 0.20g镁粉 | 3.0 mL0.2mol/LNaNO3溶液 |
| 实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
| 实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是NH4NO3溶液(左试管)和KNO3溶液(右试管)分别与Mg粉反应,左试管反应剧烈,有大量气泡生成,右试管反应很少,没有气泡生成
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式Mg+2 NH4+=Mg2++2NH3↑+H2↑.
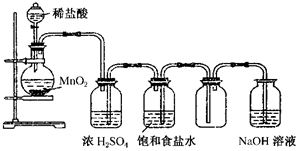 如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.
如图所示是某学生设计的实验室制备干燥Cl2及吸收多余Cl2的实验装置图,根据图中的装置和有关试剂回答下列问题.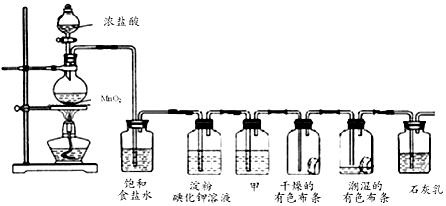
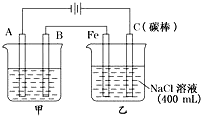 如图为相互串联的甲乙两电解池,试回答:
如图为相互串联的甲乙两电解池,试回答: