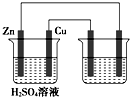
题目内容
用导线将铜片和锌片连接后插入稀硫酸中组成原电池,其中锌片作( )
| A、阳极 | B、阴极 | C、正极 | D、负极 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铜、锌和稀硫酸能构成原电池,锌易失电子而作负极,铜作正极.
解答:
解:将铜片与锌片用导线连接入插入稀硫酸中,符合原电池的构成条件,所以锌、铜和稀硫酸构成原电池,锌片易失电子发生氧化反应而作负极,则铜作正极,正极上氢离子得电子发生还原反应,
故选D.
故选D.
点评:本题考查了原电池正负极的判断,难度不大,注意原电池中活泼性强的金属为负极,阴阳极为电解池中的电极名称.

练习册系列答案
相关题目
常温下,能被浓硝酸钝化的金属是( )
| A、Mg | B、Fe | C、Cu | D、Al |
短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍.下列说法正确的是( )
| A、原子半径的大小顺序:r(B)>r(C)>r(A) |
| B、元素E的氧化物的水化物一定是强酸 |
| C、D单质在一定条件下可以与氧化铁发生置换反应 |
| D、工业上常用电解元素C、D的氯化物来制取它们的单质 |
下列叙述中错误的是( )
| A、NaHCO3溶液与NaHSO4溶液混合能发生化学反应 |
| B、过氧化钠很活泼,在反应中易失去电子,作氧化剂 |
| C、相同质量的Na2CO3 与NaHCO3分别与足量盐酸反应,NaHCO3 放出CO2更多 |
| D、相同质量、相同质量分数的两份盐酸分别与足量Na2CO3 和NaHCO3反应,NaHCO3与酸反应比Na2CO3剧烈 |
 如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )| A、铜在原电池中作负极,在电镀池中作阳极 |
| B、原电池溶液增加的质量比电镀池阴极增加的质量大 |
| C、锌棒每减少0.65 g,导线上转移的电子约为1.204×1022个 |
| D、电路中电子的移动方向是从Zn沿导线到电镀池的铜极,再经过溶液到铁棒 |
化学平衡常数K、弱电解质的电离平衡常数Ka或Kb及溶度积常数Ksp是高中化学中常见的几种常数.它们都能反映相应的可逆变化进行的程度,下列关于以上常数的说法正确的是( )
| A、对于可逆反应,若改变条件使平衡右移,则到达新的平衡时的平衡常数K一定增大 |
| B、一定温度下,在a mol?L-1的饱和石灰水中加入适量的b mol?L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出 |
| C、相同温度时,CH3COOH的电离平衡常数Ka与NH3?H2O的电离平衡常数Kb相等,所以NH4HCO3的水溶液显碱性 |
| D、升高温度,以上常数均增大 |
下列关于有机物的表述正确的是( )
| A、油脂、淀粉、蛋白质均为可水解的高分子化合物 | ||||
| B、乙烯、苯、乙酸分子中的所有原子都在同一平面上 | ||||
| C、石油催化裂化的主要目的是为了获得汽油等轻质油 | ||||
D、实验室中制取乙酸乙酯的化学方程式为CH3COOH+H18OC2H5
|
下列变化中(不考虑电解),必须加入氧化剂才能实现的是( )
| A、Cl-→Cl2 |
| B、Fe3+→Fe2+ |
| C、Al3+→AlO2- |
| D、H2O2→O2 |
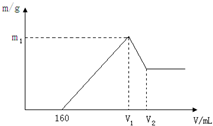 将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题:
将镁铝的混合物0.1mol溶于100mL 2mol?L-1硫酸溶液中,然后再滴加1mol?L-1氢氧化钠溶液,请回答以下问题: