题目内容
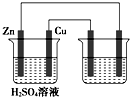 如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )| A、铜在原电池中作负极,在电镀池中作阳极 |
| B、原电池溶液增加的质量比电镀池阴极增加的质量大 |
| C、锌棒每减少0.65 g,导线上转移的电子约为1.204×1022个 |
| D、电路中电子的移动方向是从Zn沿导线到电镀池的铜极,再经过溶液到铁棒 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A、活泼性强的为负极,镀层金属作阳极;
B、根据电池中的反应判断;
C、根据反应中Zn与电子的关系计算;
D、电子不能在溶液中移动.
B、根据电池中的反应判断;
C、根据反应中Zn与电子的关系计算;
D、电子不能在溶液中移动.
解答:
解:A、活泼性强的为负极,所以在铜锌原电池,Zn为负极,镀层金属作阳极,则在电镀池中Cu作阳极,故A错误;
B、铜锌原电池的反应为:Zn+2H+=Zn2++H2↑,若1molZn反应溶液的质量增加为65-2=63g,电镀池阴极析出Cu增加64g,故B错误;
C、原电池中负极为:Zn-2e-=Zn2+,锌棒每减少0.65g即0.01mol,导线上转移的电子为0.02mol,约为1.204×1022个,故C正确;
D、电子只能在导线中移动,不能在溶液中移动,故D错误.
故选C.
B、铜锌原电池的反应为:Zn+2H+=Zn2++H2↑,若1molZn反应溶液的质量增加为65-2=63g,电镀池阴极析出Cu增加64g,故B错误;
C、原电池中负极为:Zn-2e-=Zn2+,锌棒每减少0.65g即0.01mol,导线上转移的电子为0.02mol,约为1.204×1022个,故C正确;
D、电子只能在导线中移动,不能在溶液中移动,故D错误.
故选C.
点评:本题考查原电池和电解池知识,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,难度不大.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA |
| C、标准状况下,11.2LCCl4中含有分子的数目为0.5NA |
| D、1.0L 0.1 mol?L-1 AlCl3溶液中所含的Al3+离子数为0.1NA |
下列液体均处于25℃,有关叙述正确的是( )
| A、某物质的溶液pH<7,则该物质属于酸或强酸弱碱盐 |
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| D、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
下列说法正确的是( )
| A、淀粉、油脂、氨基酸都能水解,但水解产物不同 |
| B、甲醛可用作食品防腐剂,SO2不能漂白食品 |
| C、植物油和裂化汽油都能使溴水褪色 |
| D、对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
下列叙述不正确的是( )
| A、与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 |
| B、氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| C、化学键可以使离子相结合,也可以使原子相结合 |
| D、离子键、共价键、氢键都属于化学键 |
用导线将铜片和锌片连接后插入稀硫酸中组成原电池,其中锌片作( )
| A、阳极 | B、阴极 | C、正极 | D、负极 |
下面的化学实验各操作正确的一组是:( )
①蒸发操作,待蒸发皿中的水基本蒸干时,就可停止加热;蒸馏时冷却水从冷凝管下端进入,上端出来.
②向天平托盘中加少量固体时应用右手拿药匙,左手轻轻拍打右手的手腕,让少量药品掉落托盘上;
③过滤时,使漏斗下端管口垂直的一面紧靠烧杯内壁,洗涤沉淀时不能用玻璃棒搅拌;
④玻璃仪器洗后,如果内壁的水附着均匀,既不聚成水滴也不成股流下,才算洗干净.
①蒸发操作,待蒸发皿中的水基本蒸干时,就可停止加热;蒸馏时冷却水从冷凝管下端进入,上端出来.
②向天平托盘中加少量固体时应用右手拿药匙,左手轻轻拍打右手的手腕,让少量药品掉落托盘上;
③过滤时,使漏斗下端管口垂直的一面紧靠烧杯内壁,洗涤沉淀时不能用玻璃棒搅拌;
④玻璃仪器洗后,如果内壁的水附着均匀,既不聚成水滴也不成股流下,才算洗干净.
| A、①②④ | B、①②③ |
| C、①③④ | D、②③④ |
某有机物甲经氧化得乙(C2H3O2Cl),而甲在NaOH水溶液中加热反应可得丙.1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2).由此可推断甲的结构简式为( )
A、 |
B、 |
| C、CH2ClCHO |
| D、HOCH2CH2OH |