题目内容
15.分子有极性分子和非极性分子.下列对极性分子和非极性分子的认识正确的是( )| A. | 含非极性键的分子一定是非极性分子 | |
| B. | 含有极性键的分子一定是极性分子 | |
| C. | 非极性分子一定含有非极性键 | |
| D. | 极性分子不一定只含有极性键 |
分析 A.分子中正负电荷中心不重合为极性分子,只含非极性键的分子可能为极性分子;
B.由极性键构成的分子,如果结构对称,正负电荷的中心重合,则为非极性分子,否则为极性分子;
C.非极性分子中可能只含极性键;
D.过氧化氢为极性分子,但既含有极性键也含有非极性键.
解答 解:A.空间构型不对称的分子为极性分子,如O3分子的结构如图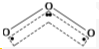 只含非极性键,空间构型不对称,正负电荷重心不重合,是极性分子,故A错误;
只含非极性键,空间构型不对称,正负电荷重心不重合,是极性分子,故A错误;
B.含有极性键的分子不一定是极性分子,如CO2是非极性分子,故B错误;
C.非极性分子中可能只含极性键,如CH4,故C错误;
D.过氧化氢为极性分子,但既含有极性键也含有非极性键,故D正确;
故选D.
点评 本题考查了键的极性与分子极性,注意同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子,本题难度不大.

练习册系列答案
相关题目
5.用一种试剂鉴别苯酚、己烯、碘化钾溶液、苯四种液体,可选用( )
| A. | 盐酸 | B. | FeCl3溶液 | C. | 溴水 | D. | 四氯化碳 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 0.5 mol•L-1 Na2CO3溶液中含有的CO32-数目为0.5NA | |
| B. | 标准状况下,2.24 L C4H8含有的共用电子对数等于1.1NA | |
| C. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| D. | 27 g Al在标准状况下2.4 L Cl2中燃烧,转的2移的电子总数为3NA |
20.下列实验操作中,正确的是( )
| A. |  滴加液体 | B. |  稀释浓硫酸 | C. |  检查气密性 | D. |  熄灭酒精灯 |
7.工业上使用石油热裂解的副产物CH4来制取CO和H2,其生产流程如图1:
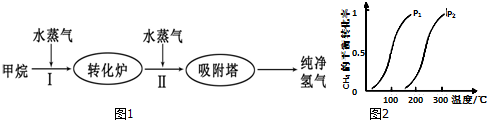
(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),
一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2(填“<”、“>”或“=”).
100℃时,将1mol CH4和2mol H2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-4.
(2)此流程的第II步反应的平衡常数随温度的变化如下表:
从上表可以推断:该反应是放热反应(填“吸热”或“放热”).
图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,图中t2时刻发生改变的条件是降低温度,或增加水蒸汽的量,或减少氢气的量(写出一种).
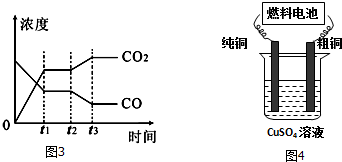
(3)工业上常利用第Ⅰ步反应产生的CO和H2在“催化反应室”中合成二甲醚(CH3OCH3).在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1kJ/mol.
(4)用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(见图4),在接通电路一段时间纯铜质量增加6.4g.
请写出燃料电池中的正极反应式:O2+2H2O+4e-=4OH-.
燃料电池正极消耗空气的体积是5.6L(标准状况,空气中O2体积分数以20%计算).

(1)此流程的第I步反应为:CH4(g)+H2O(g)?CO(g)+3H2(g),
一定条件下CH4的平衡转化率与温度、压强的关系如图2.则P1<P2(填“<”、“>”或“=”).
100℃时,将1mol CH4和2mol H2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=2.25×10-4.
(2)此流程的第II步反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
图3表示该反应在t1时刻达到平衡,在t2时刻因改变某个条件引起浓度变化的情况,图中t2时刻发生改变的条件是降低温度,或增加水蒸汽的量,或减少氢气的量(写出一种).

(3)工业上常利用第Ⅰ步反应产生的CO和H2在“催化反应室”中合成二甲醚(CH3OCH3).在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
催化反应室中总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=-246.1kJ/mol.
(4)用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(见图4),在接通电路一段时间纯铜质量增加6.4g.
请写出燃料电池中的正极反应式:O2+2H2O+4e-=4OH-.
燃料电池正极消耗空气的体积是5.6L(标准状况,空气中O2体积分数以20%计算).
4.根据下列5种元素的电离能数据(单位:kJ.mol-1)
它们的氯化物的化学式,最可能正确的是( )
| 元素符号 | I1 | 中&华&资*源%库I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| V | 420 | 3100 | 4400 | 5900 |
| A. | QCl2 | B. | RCl | C. | SCl3 | D. | TCl |
 +n HOCH2CH2OH$\stackrel{一定条件}{→}$
+n HOCH2CH2OH$\stackrel{一定条件}{→}$ +(2n-1)H2O.
+(2n-1)H2O. .
.