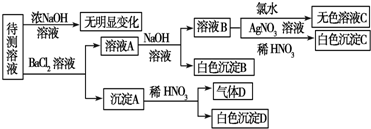
题目内容
12.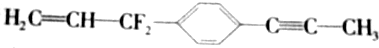 为已知结构,下列叙述中正确的是( )
为已知结构,下列叙述中正确的是( )| A. | 除苯环外的其余碳原子有可能都在同一条直线上 | |
| B. | 在同一平面上的原子最多有19个 | |
| C. | 12个碳原子不可能都在同一个平面上 | |
| D. | 12个碳原子有可能都在同一个平面上 |
分析 根据常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转.
解答 解:A.双键相连的碳与CF2的碳不在同一直线上,故A错误;
B. 为分子中,CF2中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子共面.在甲基上可能还有1个氢原子共平面,苯环上4个氢原子共平面,双键上3个氢原子共平面,总计得到可能共平面的原子有20个,故B错误;
为分子中,CF2中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子共面.在甲基上可能还有1个氢原子共平面,苯环上4个氢原子共平面,双键上3个氢原子共平面,总计得到可能共平面的原子有20个,故B错误;
C. 为分子中,CF2中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子共面,故C错误D正确.
为分子中,CF2中C原子处于苯中H原子的位置,苯环平面与碳碳双键形成的平面通过旋转碳碳单键可以处于同一平面,乙炔是直线型结构,所以最多有12个C原子共面,故C错误D正确.
故选D.
点评 本题考查有机物结构中共面、共线问题,难度中等,关键是空间想象,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构,单键可以旋转.

练习册系列答案
相关题目
2.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 71 g Cl2含有的氯原子数目为NA | |
| B. | 标准状况下,2.24 L水所含的分子数为0.1 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.4 g金属镁变成镁离子时失去的电子数目为0.2 NA |
7.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害,以制革工也产生的含铬污泥为原料,回收污泥中三价铬的工艺流程图如图所示(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+)
:
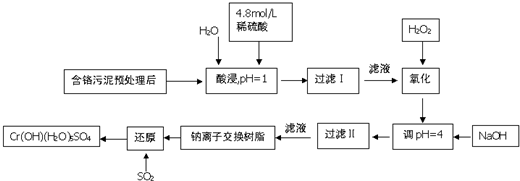
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Al(OH)3和Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+(填离子符号).
(5)每生成1mol Cr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是电解氯化钠溶液得到NaOH,从而将Fe3+、Cr3+与OH-反应生成Fe(OH)3和Cr(OH)3沉淀;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3×10-6mol•L-1(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
:

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | 9.3 | 3.7 | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)能提高浸取时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间
B.升高温度并不断搅拌
C.多次浸取,合并浸取液
D.缩短浸取时间
(2)氧化过程中加入H2O2,除了把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++H2O2+2H+=2Fe3++2H2O(用离子方程式表示).
(3)过滤Ⅱ产生的沉淀是Al(OH)3和Fe(OH)3(填化学式).
(4)钠离子交换树脂的原理为:Mn++nNaR═MRn+nNa+,被交换的杂质离子是Ca2+、Mg2+(填离子符号).
(5)每生成1mol Cr(OH)(H2O)5SO4,消耗SO2物的质量为1.5mol.
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解.经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去.
①铁电极与直流电源正极(填“正极”或“负极”)相连,加入适量NaCl的目的是电解氯化钠溶液得到NaOH,从而将Fe3+、Cr3+与OH-反应生成Fe(OH)3和Cr(OH)3沉淀;
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中c(Cr3+)为3×10-6mol•L-1(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp=[Cr(OH)3]=6.0×10-31)
17.下列说法正确的是( )
| A. | 加热法可以除去氯化铵中的少量碘单质 | |
| B. | 向试液中滴加双氧水和KSCN溶液,溶液变为红色,则试液中一定含Fe2+ | |
| C. | 向某固体中滴加稀硫酸,产生气体能使澄清石灰石变浑浊,则该固体一定是苏打或小苏打 | |
| D. | 向含少量硫酸铁的硫酸铜溶液中加入过量的氧化铜,过滤,得到纯净硫酸铜溶液 |
4.由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置是( )
| A. | 1s2 | B. | 3s23p4 | C. | 2s22p6 | D. | ns2np3 |