题目内容
12.现有原子序数依次增大的A、B、C、D、E五种短周期元素.已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水.请回答:(1)C元素在元素周期表中的位置是第三周期ⅢA族.
(2)D、E两元素的最高价氧化物的水化物中,酸性较强的是HClO4(填化学式).
(3)写出A、C两元素的最高价氧化物的水化物之间反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)将A元素的一种氧化物15.6g与足量二氧化碳完全反应,有0.2mol 电子发生转移.
分析 A、B、C、D、E五种短周期元素的原子序数依次增大,A、C、D三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝、强碱、强酸之间的反应,则A为Na、C为Al,三种原子最外层共有10个电子,则D的最外层电子数为10-1-3=6,则D为S元素,结合原子序数可知B为Mg,E为Cl,据此解答.
解答 解:A、B、C、D、E五种短周期元素的原子序数依次增大,A、C、D三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝、强碱、强酸之间的反应,则A为Na、C为Al,三种原子最外层共有10个电子,则D的最外层电子数为10-1-3=6,则D为S元素,结合原子序数可知B为Mg,E为Cl.
(1)C为Al元素,在元素周期表中的位置是:第三周期ⅢA族,
故答案为:第三周期ⅢA族;
(2)由于非金属性Cl>S,故最高价氧化物的水化物酸性:HClO4>H2SO4,
故答案为:HClO4;
(3)A、C两元素的最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)A元素的一种氧化物15.6g与足量二氧化碳完全反应有电子转移,该反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,Na2O2物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,反应中Na2O2既是氧化剂又是还原剂,各占$\frac{1}{2}$,故反应中转移电子为0.2mol×$\frac{1}{2}$×2=0.2mol,
故答案为:0.2.
点评 本题考查结构性质位置关系应用,关键是根据元素化合物性质推断元素,难度不大,注意基础知识的理解掌握,

| A. | 可用碱式滴定管量取12.85 mL KMnO4溶液 | |
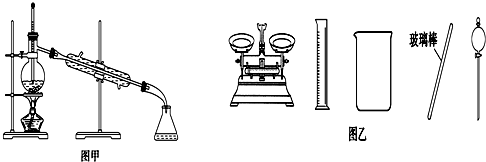
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol•L-1 NaCl溶液,必要的仪器如图乙所示 |
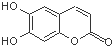 中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A. | 2 mol Br2 2 mol NaOH | B. | 2 mol Br2 3 mol NaOH | ||
| C. | 3 mol Br2 4 mol NaOH | D. | 4 mol Br2 4 mol NaOH |

| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
| A. | 苯不能使酸性KMnO4溶液褪色.因此苯不能发生氧化反应 | |
| B. | 1mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| C. | 用碳酸钠溶液可一次性鉴别乙酸、苯和乙醇三种无色液体 | |
| D. | 戊烷的一氯代物和丙烷的二氯代物的同分异构体数目相同 |
| A. | CH3-CH3+Cl2→CH3-CH2Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2 H2O | |
| C. | CH3-CH═CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +3H2 $→_{△}^{催化剂}$ +3H2 $→_{△}^{催化剂}$ |