题目内容
4.求下列溶液的pH与pOH(1)0.001mol/L HCl溶液;
(2)0.0050mol Ba(OH)2溶液;
(3)0.030mol/L HCl溶液与0.040mol/L NaOH溶液各100ml混合后稀释至1.0L.
分析 pH=-lgc(H+),pOh=-lgc(OH-),常温下,pH+pOH=14,如酸碱混合,应先判断溶液的酸碱性,在计算pH或pOH,以此解答该题.
解答 解:(1)0.001mol/L HCl溶液pH=-lgc(H+)=3,则pOH=11,
答:0.001mol/L HCl溶液pH=3,pOH=11;
(2)0.0050mol Ba(OH)2溶液,c(OH-)=0.01mol/L,pOH=2,pH=12,
答:0.0050mol Ba(OH)2溶液pH=12,pOH=2;
(3)0.030mol/L HCl溶液与0.040mol/L NaOH溶液各100ml混合后稀释至1.0L,其中n(HCl)=0.003mol,n(NaOH)=0.004mol,反应后c(OH-)=$\frac{0.004mol-0.003mol}{1L}$=0.001mol/L,pH=11,pOH=3,
答:0.030mol/L HCl溶液与0.040mol/L NaOH溶液各100ml混合后稀释至1.0L时pH=11,pOH=3.
点评 本题考查溶液pH、pOH的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,把握pH与pOH的区别,难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
8.在恒温恒容条件下,能使A(g)+2B(g)?C(g)+D (g) 正反应速率增大的措施是( )
| A. | 增大D的浓度 | B. | 减小C的浓度 | C. | 减小B的浓度 | D. | 减小压强 |
19.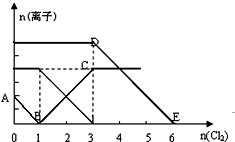 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
9.两种微粒的电子数相同,而质子数不同,这两种微粒可能是( )
| A. | 不同种元素的原子 | B. | 不同种分子 | ||
| C. | 一种是分子,另一种是离子 | D. | 一种是分子,另一种是原子 |
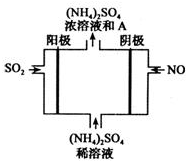 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.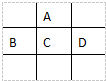 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题: .
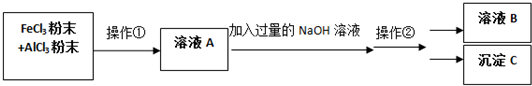
.
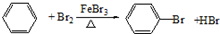 反应类型取代反应.
反应类型取代反应.