题目内容
纳米ZnS具有独特的光电效应,在电学、磁学、光学等领域应用广泛.以工业废渣锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
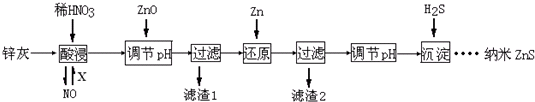
请回答下列问题:
(1)酸浸时FeO与稀HNO3反应的离子方程式 .
(2)为了将酸浸的尾气循环利用,加入的X气体可以是 .
(3)流程中加入ZnO调pH的目的是 .
(4)滤渣2中的成分是 .
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol?L-1,则溶液中S2-浓度大于 mol?L-1,才生成ZnS沉淀.
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级 .

请回答下列问题:
(1)酸浸时FeO与稀HNO3反应的离子方程式
(2)为了将酸浸的尾气循环利用,加入的X气体可以是
(3)流程中加入ZnO调pH的目的是
(4)滤渣2中的成分是
(5)已知ZnS的溶度积Ksp=1.6×10-24,溶液中Zn2+浓度为0.01mol?L-1,则溶液中S2-浓度大于
(6)试设计简单实验方案,判断所得ZnS样品颗粒是否为纳米级
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)加入稀硝酸溶解,根据硝酸的强氧化性则所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,再加锌置换成溶液中铜而过滤除去,最后调节PH再使锌离子转化成氢氧化锌沉淀,再用硫化氢溶解沉淀氢氧化锌得到ZnS,以此解答;
(1)酸浸时FeO与稀HNO3反应根据稀硝酸的强氧化性书写离子方程式;
(2)根据稀硝酸酸浸的尾气为一氧化氮,结合循环利用进一步再转化成硝酸分析.
(3)根据以上分析解答;
(4)根据以上分析解答;
(5)根据Qc>Ksp,才生成ZnS沉淀计算;
(6)根据胶体的粒子是纳米级的设计判断.
(1)酸浸时FeO与稀HNO3反应根据稀硝酸的强氧化性书写离子方程式;
(2)根据稀硝酸酸浸的尾气为一氧化氮,结合循环利用进一步再转化成硝酸分析.
(3)根据以上分析解答;
(4)根据以上分析解答;
(5)根据Qc>Ksp,才生成ZnS沉淀计算;
(6)根据胶体的粒子是纳米级的设计判断.
解答:
解:锌灰(主要成分为Zn、ZnO,还含有Fe2O3、FeO、CuO等杂质)加入稀硝酸溶解,根据硝酸的强氧化性则所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,再加锌置换成溶液中铜而过滤除去,最后调节PH再使锌离子转化成氢氧化锌沉淀,再用硫化氢溶解沉淀氢氧化锌得到ZnS;
(1)由于稀硝酸的强氧化性,所以FeO与稀HNO3反应离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故答案为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O;
(2)稀硝酸酸浸的尾气为一氧化氮,根据要循环利用则将NO进一步再转化成硝酸即4NO+3O2+2H2O=4HNO3,所以通空气或者氧气,故答案为:空气(或O2);
(3)由于硝酸的强氧化性则酸溶解所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,
故答案为:除去溶液中的Fe3+;
(4)由于硝酸的强氧化性则酸溶解所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,再加锌置换成溶液中铜而过滤除去,所以最终过量出来的处理置换出的铜还有过量的锌,故答案为:Cu、Zn;
(5)当Qc>Ksp,才生成ZnS沉淀,即S2-浓度大于
=
=1.6×10-22 mol?L-1,故答案为:1.6×10-22;
(6)根据胶体的粒子是纳米级的,则取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是,
故答案为:取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
(1)由于稀硝酸的强氧化性,所以FeO与稀HNO3反应离子方程式为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O,故答案为:3FeO+10H++NO3-=3Fe3++NO↑+5H2O;
(2)稀硝酸酸浸的尾气为一氧化氮,根据要循环利用则将NO进一步再转化成硝酸即4NO+3O2+2H2O=4HNO3,所以通空气或者氧气,故答案为:空气(或O2);
(3)由于硝酸的强氧化性则酸溶解所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,
故答案为:除去溶液中的Fe3+;
(4)由于硝酸的强氧化性则酸溶解所得溶液中含有三价铁、二价锌、二价铜离子,再加入氧化锌调节PH值先使三价铁以氢氧化铁沉淀而过滤除去,再加锌置换成溶液中铜而过滤除去,所以最终过量出来的处理置换出的铜还有过量的锌,故答案为:Cu、Zn;
(5)当Qc>Ksp,才生成ZnS沉淀,即S2-浓度大于
| K sp |
| C(Zn 2+) |
| 1.6×10 -24 |
| 0.01 |
(6)根据胶体的粒子是纳米级的,则取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是,
故答案为:取少量样品和水混合形成分散系,让一束光照射,若出现一条光亮的通路,则是纳米级,否则不是.
点评:本题考查较为综合,涉及氧化还原反应、盐类的水解的应用、物质的分离提纯以及Ksp的计算,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.

练习册系列答案
相关题目
由相同条件下的三个反应:①2NaA+B2=2NaB+A2; ②2NaC+A2=2NaA+C2;③2NaB+D2=2NaD+B2;可判断( )
| A、氧化性:A2>B2>C2>D2 |
| B、还原性:C->A->B->D- |
| C、2NaD+A2=2NaA+D2可进行 |
| D、2NaC+B2=2NaB+C2不能进行 |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A、X与Y形成化合物是,X可以显负价,Y显正价 |
| B、第一电离能可能Y小于X |
| C、最高价含氧酸的酸性:X对应的酸性弱于Y对应的 |
| D、气态氢化物的稳定性:HmY小于HmX |
下列说法正确的是( )
| A、pH=3的HX酸与pH=11的YOH碱等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L (NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、在醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2 mol/L HCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |