题目内容
某同学设计了以下流程来检验碳酸钾粉末中含有少量氯化钾和氢氧化钾.下列说法不正确的是( )
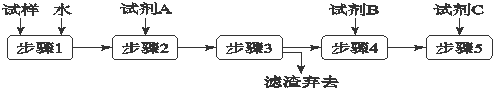

| A、步骤3的操作名称是过滤 |
| B、步骤1所需玻璃仪器是烧杯和玻璃棒 |
| C、试剂A是BaCl2溶液 |
| D、加入试剂A 的目的是除去CO32-并避免对Cl-或OH-的检验的干扰 |
考点:物质的检验和鉴别的实验方案设计
专题:实验设计题
分析:检验碳酸钾粉末中含有少量氯化钾和氢氧化钾,由实验流程可知,加水均溶解,步骤1为溶解,步骤2中加试剂A为硝酸钡将碳酸根离子转化为沉淀,步骤3为过滤,步骤4中检验溶液是否为碱性,步骤5中检验是否存在氯离子,以此来解答.
解答:
解:检验碳酸钾粉末中含有少量氯化钾和氢氧化钾,由实验流程可知,加水均溶解,步骤1为溶解,步骤2中加试剂A为硝酸钡将碳酸根离子转化为沉淀,步骤3为过滤,步骤4中检验溶液是否为碱性,步骤5中检验是否存在氯离子,
A.由上述分析可知,步骤3的操作名称是过滤,过滤除去碳酸钡,故A正确;
B.步骤1为溶解操作,所需玻璃仪器是烧杯和玻璃棒,故B正确;
C.试剂A是硝酸钡,若加BaCl2溶液,干扰氯离子的检验,故C错误;
D.加入试剂A为硝酸钡,其的目的是除去CO32-并避免对Cl-或OH-的检验的干扰,故D正确;
故选C.
A.由上述分析可知,步骤3的操作名称是过滤,过滤除去碳酸钡,故A正确;
B.步骤1为溶解操作,所需玻璃仪器是烧杯和玻璃棒,故B正确;
C.试剂A是硝酸钡,若加BaCl2溶液,干扰氯离子的检验,故C错误;
D.加入试剂A为硝酸钡,其的目的是除去CO32-并避免对Cl-或OH-的检验的干扰,故D正确;
故选C.
点评:本题考查物质的检验实验方案的设计,为高频考点,把握流程中发生的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意离子检验的分析与应用,题目难度不大.

练习册系列答案
相关题目
日本福岛第一核电站泄漏出微量的钚(Pu)-239.下列关于
Pu叙述准确的是( )
239 94 |
| A、原子序数是239 |
| B、质量数是94 |
| C、中子数是239 |
| D、质子数是94 |
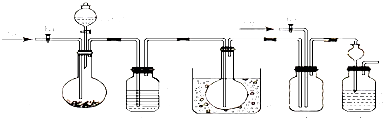
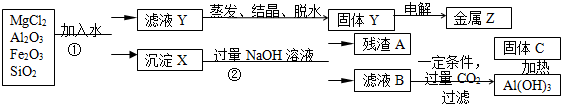
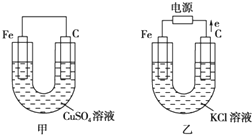 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后: 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.