题目内容
17.在通常条件下,下列各组物质的性质排列正确的是( )| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:NaH>H2O>H2S | D. | 硬度:SiC>石墨>CaCO3 |
分析 A.原子晶体大于离子晶体大于分子晶体的沸点;
B.H2S微溶于水;
C、离子晶体的沸点高于分子晶体,水分子中存在氢键;
D、石墨是过渡形晶体,层与层之间是分子间作用力.
解答 解:A.一般来说原子晶体大于离子晶体大于分子晶体的沸点,则沸点:CO2<KCl<SiO2,故A错误;
B.根据相似相溶可知,分子的极性越大,越易溶于水,则有HCl>SO2>H2S,故B错误;
C、离子晶体的沸点高于分子晶体,水分子中存在氢键,所以沸点:NaH>H2O>H2S,故C正确;
D、石墨是过渡形晶体,层与层之间是分子间作用力,SiC是原子晶体,所以硬度:SiC>CaCO3>石墨,故D错误;
故选C.
点评 本题考查晶体的性质比较、氢化物的稳定性、相似相溶原理等知识,题目难度不大,本题注意影响晶体熔沸点高低的因素.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
8.除去氯化钠溶液中少量的碘,常用的方法是( )
| A. | 蒸发 | B. | 升华 | C. | 结晶 | D. | 萃取 |
12.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 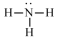 氨分子的结构式 | B. | 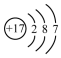 Cl-结构示意图 | C. | 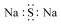 Na2S的电子式 | D. | 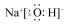 NaOH的电子式 |
2.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;继续加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在.
该白色粉末可能为( )
①取少量样品加入足量水仍有部分固体未溶解;继续加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在.
该白色粉末可能为( )
| A. | Na2CO3、Al(OH)3 | B. | AgCl、NaHCO3 | C. | NaHCO3、BaCO3 | D. | Na2SiO3、CuO |
9.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | NaHCO3溶液中:c (CO32-)+c(H+)=c(H2CO3)+c(OH-) | |
| C. | 1 L 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 17g氨气所含电子数目为8NA | |
| C. | 将1体积c1mol/L的硫酸溶于4体积水中,稀溶液的浓度为0.2c1mol/L | |
| D. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 |
7.向含有下列离子的溶液中分别加入烧碱固体(体积变化忽略),离子浓度减小的是 ①Na+、②HCO3-、③Cl-、④Ca2+ ⑤NH4+ ⑥SO42-( )
| A. | ②③④ | B. | ③④⑤ | C. | ②④⑥ | D. | ②④⑤ |