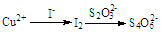题目内容
7.向含有下列离子的溶液中分别加入烧碱固体(体积变化忽略),离子浓度减小的是 ①Na+、②HCO3-、③Cl-、④Ca2+ ⑤NH4+ ⑥SO42-( )| A. | ②③④ | B. | ③④⑤ | C. | ②④⑥ | D. | ②④⑤ |
分析 烧碱为氢氧化钠,氢氧化钠与碳酸氢根离子、钙离子、铵根离子反应,加入烧碱后,②HCO3-、④Ca2+、⑤NH4+三种离子浓度减小.
解答 解:加入烧碱固体后,②HCO3-与氢氧化钠发生中和反应生成碳酸根离子和水,④Ca2+与氢氧根离子反应生成微溶物氢氧化钙,导致钙离子浓度减小,⑤NH4+与NaOH反应生成一水合氨,导致铵根离子浓度减小,所以离子浓度减小的为②④⑤,
故选D.
点评 本题考查了离子共存的应用,题目难度不大,明确离子反应发生条件为解答关键,注意掌握离子共存的判断方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
17.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>H2S>SO2 | ||
| C. | 沸点:NaH>H2O>H2S | D. | 硬度:SiC>石墨>CaCO3 |
18.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),(银白色→变暗→表面变潮→结块→变成粉末).下列有关叙述中错误的是( )
| A. | 表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠 | |
| B. | “出汗”是因为生成的氢氧化钠吸收空气中的CO2在表面形成了溶液 | |
| C. | 最后变成碳酸钠粉末 | |
| D. | 该过程中的所有化学反应均为氧化还原反应 |
15.下列有关物质应用的说法正确的是( )
| A. | 生石灰用作食品抗氧剂 | B. | 氢氧化铝用于制胃酸中和剂 | ||
| C. | 硫酸可作干燥剂 | D. | 氧化铁能用于制作吸铁石 |
2.对于化工生产中的化学反应,既要考虑反应的限度和快慢,还要综合考虑成本、设备等因素.
工业制硫酸的重要的一步反应是:2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)在不增加反应物的前提下,从理论上考虑,既能加快反应速率,又能提高SO2转化率的条件是增大压强.
(2)实际生产中的条件是:500℃、催化剂(V2O2),1标准大气压并不断鼓入空气.
①采用500℃的目的是催化剂活性最大.
②用平衡移动原理解释生产过程中不断鼓入空气的目的增大二氧化硫的转化率.
③下表是500℃,不同压强时SO2转化率的变化情况:
请结合表中信息说明采用1标准大气压而不采用更高压强的原因:常压时的转化率较高、高压成本高.
工业制硫酸的重要的一步反应是:2SO2(g)+O2(g)?2SO3(g)△H<0.
(1)在不增加反应物的前提下,从理论上考虑,既能加快反应速率,又能提高SO2转化率的条件是增大压强.
(2)实际生产中的条件是:500℃、催化剂(V2O2),1标准大气压并不断鼓入空气.
①采用500℃的目的是催化剂活性最大.
②用平衡移动原理解释生产过程中不断鼓入空气的目的增大二氧化硫的转化率.
③下表是500℃,不同压强时SO2转化率的变化情况:
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
12.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A. | 铁在氯气中燃烧,生成棕红色的烟 | |
| B. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| C. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾 | |
| D. | 氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
16.下列有关浓硫酸的认识正确的是( )
| A. | 浓硫酸具有吸水性,可用来干燥H2S | B. | 浓硫酸在常温下不与铁和铝反应 | ||
| C. | 可将蒸馏水注入浓硫酸进行稀释 | D. | 棉花接触浓硫酸后会变黑 |
1.卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按图所示流程进行生产,可制得轻质氧化镁.
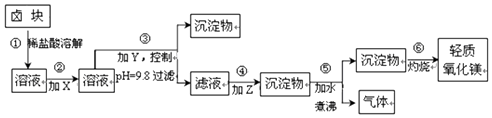
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd( 选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.

| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| 资*源%库Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的acd( 选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2↓+CO2↑.
(3)步骤③控制pH=9.8的目的是使除Mg2+以外的各种杂质金属离子都成为氢氧化物沉淀以便除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、坩埚和泥三角.