题目内容
2.标准状况下,2.24LNO中含有的电子数为1.5mol,质子数有1.5NA个.分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下2.24LNO的物质的量,NO分子中含有15个质子,根据N=nNA计算出该NO气体中含有的质子数.
解答 解:标准状况下2.24L NO的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
0.1molNO分子中含有质子的物质的量为:0.1mol×15=1.5mol,含有质子数为1.5NA,
故答案为:1.5;1.5NA.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与气体摩尔体积之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
相关题目
13.一般情况下,前者无法决定后者的是( )
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 可逆反应向正方向进行的程度--电离常数的大小 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
10.下列关于有机物的同分异构体的说法中,不正确的是(不考虑立体异构)( )
| A. | 分子式为C3H6Cl2的同分异构体有3种 | |
| B. | 分子式为C5H12O,且能与金属钠反应的同分异构体有8种 | |
| C. | 分子式为C4H8O2属于羧酸类的同分异构体有2种 | |
| D. | 分子式为C4H8O2属于酯类的同分异构体有4种 |
17.已知乙酸和乙酸乙酯的混合物中含H质量分数为7.8%,则其中含氧质量分数是( )
| A. | 45.4% | B. | 49.8% | C. | 51.4% | D. | 15.6% |
7.某元素最高正化合价与最低负价的绝对值之差为 4,该元素的离子跟其核外电子排布相同的离子所形成的化合物是( )
| A. | NaF | B. | CaO | C. | K2S | D. | MgS |
11.下列说法正确的是( )
| A. | CaCO3是共价化合物 | |
| B. | 羟基既含有共价键又含有离子键 | |
| C. | O2分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | SO2是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
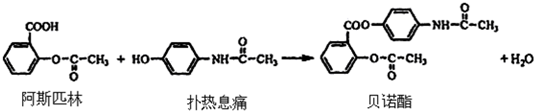
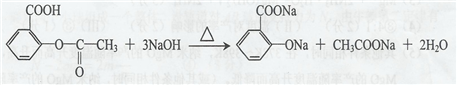 .
.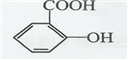 .
.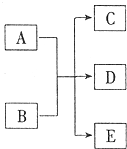 一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.