题目内容
11.下列说法正确的是( )| A. | CaCO3是共价化合物 | |
| B. | 羟基既含有共价键又含有离子键 | |
| C. | O2分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | SO2是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
分析 A.CaCO3含有离子键和极性键;
B.羟基中只含有共价键;
C.根据O2分子的结构式分析;
D.SO2是分子晶体,其溶于水生成亚硫酸,发生化学反应.
解答 解:A.CaCO3含有离子键和极性键,属于离子化合物,只含有共价键的化合物属于共价化合物,故A错误;
B.羟基不显电性,羟基中只含有共价键,不含有离子键,故B错误;
C.O2分子的结构式为O=O,O原子含有6个电子,共用电子对又提供2个电子,所以每个原子的最外层都具有8电子稳定结构,故C正确;
D.SO2是分子晶体,其溶于水生成亚硫酸,发生化学反应,化学键被破坏,故D错误.
故选C.
点评 本题考查了共价键、离子键、共价化合物和离子化合物,以及8电子稳定结构等,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
1.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
19.下列属于碱性氧化物的是( )
| A. | Ba(OH)2 | B. | Na2O2 | C. | SiO2 | D. | Fe2O3 |
6.下列说法不正确的是( )
| A. | 金刚石跟石墨是同素异形体 | B. | 126C和146C是同位素 | ||
| C. | 不同的核素质子数可能相同 | D. | C2H4和C3H6一定是同系物 |
3.下列说法正确的是( )
| A. | 乙醇和乙二醇互为同系物 | |
| B. | 异丙苯(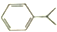 )分子中碳原子可能都处于同一平面 )分子中碳原子可能都处于同一平面 | |
| C. | 按系统命名法,化合物(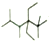 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 | |
| D. | 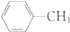 的一溴代物和 的一溴代物和 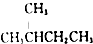 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
20.阿伏加德罗常数是物理学和化学中的一个重要常量.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,25.5g NH3所含的原子数为6NA | |
| C. | 标准状况下,11.2L水所含的分子数为0.5NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
7.下列说法不正确的是( )
| A. | 锅炉水垢用Na2CO3溶液浸泡一段时间后,可用盐酸溶解 | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,固体颜色变深 | |
| C. | NaH2PO4溶液显酸性,Na2HPO4溶液显碱性,两种溶液中都有电离平衡和水解平衡 | |
| D. | 等物质的量浓度的(NH4)2CO3,(NH4)2SO4,(NH4)2Fe(SO4)2三种溶液,NH${\;}_{4}^{+}$浓度相等 |
