题目内容
13.一般情况下,前者无法决定后者的是( )| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 可逆反应向正方向进行的程度--电离常数的大小 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
分析 A、元素在周期表中呈现规律性的变化与其核外电子排布有关;
B、稳定性与化学键有关,分子间作用力决定物质的物理性质;
C、电离常数越大说明该弱电解质越易电离;
D、物质内部储存的能量即键能,断开化学键与形成化学键决定化学反应的热效应.
解答 解:A、因为原子核外电子排布呈现规律性的变化,故元素在周期表中的位置也呈现规律性的变化,即原子核外电子排布决定了元素在周期表中的位置,故A正确;
B、稳定性与化学键有关,分子间作用力决定物质的物理性质,则分子晶体的稳定性决定于其中的化学键,故B错误;
C、相同类型的弱电解质,其电离常数越大说明该弱电解质越易电离,故C正确;
D、反应物的总能量大于生成物的总能量,则反应放热,否则吸热,即物质内部储存的能量决定了化学反应的热效应,故D正确,
故选B.
点评 本题主要考查的是元素周期表的形成、弱电解质的电离与电离常数、反应热效应等,综合性较强,有一定难度.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
1.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
8.科学家将液态的金属镓(Ga)充入碳纳米管中,发明出一种世界上最小的温度计-碳纳米管温度计.该温度计通过电子显微镜进行读数,精确度较高,其测量范围在18℃~490℃.下列说法错误的是( )
| A. | 碳纳米管中的镓为液体 | |
| B. | 金属镓的体积在10℃~500℃之间随温度的变化比较均匀 | |
| C. | 碳纳米管的体积在10℃~500℃之间随温度的变化很小 | |
| D. | Al(OH)3、Ga(OH)3均是两性氧化物 |
5.苹果酸的结构简式如图所示,下列说法正确的是( )
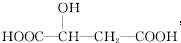
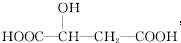
| A. | 苹果酸中能发生酯化反应的官能团有1种 | |
| B. | 1 mol苹果酸可与3 mol NaHCO3发生中和反应 | |
| C. | 1 mol苹果酸与足量金属 Na反应生成生成mol H2 | |
| D. | 1 mol苹果酸可以形成三元或四元环状内酯 |
3.下列说法正确的是( )
| A. | 乙醇和乙二醇互为同系物 | |
| B. | 异丙苯(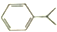 )分子中碳原子可能都处于同一平面 )分子中碳原子可能都处于同一平面 | |
| C. | 按系统命名法,化合物(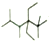 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 | |
| D. | 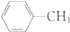 的一溴代物和 的一溴代物和 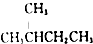 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |