题目内容
14.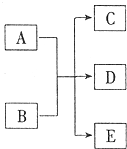 一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.(1)若A、C、D均含氯元素,C为氯碱工业的原料,D溶液具有漂白性,则A与B反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;检验C中所含阴离子的操作方法是取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-.
(2)若A为红色金属,B为某酸的浓溶液,D为可形成酸雨的无色气体.A与B反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质是什么,其实验方法是取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
分析 (1)一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体,若A、C、D均含氯元素,C为氯碱工业的原料判断为NaCl,D溶液具有漂白性为NaClO,则A为Cl2,B位NaOH,检验氯离子是利用硝酸酸化的硝酸银溶液检验;
(2)若A为红色金属,B为某酸的浓溶液,D为可形成酸雨的无色气体位SO2,则A为Cu,B为浓硫酸;
(3)上述(1)中D为NaClO、(2)中的D为SO2都能使品红溶液褪色,利用褪色后的溶液探究使品红溶液褪色的物质.
解答 解:(1)一定条件,物质A~E转化关系如图,其中A为单质,常温下E为无色液体,若A、C、D均含氯元素,C为氯碱工业的原料判断为NaCl,D溶液具有漂白性为NaClO,则A为Cl2,B位NaOH,A与B反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,检验C中所含阴离子为氯离子,取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;取少量待测液于试管中,滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-;
(2)若A为红色金属,B为某酸的浓溶液,D为可形成酸雨的无色气体位SO2,则A为Cu,B为浓硫酸,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)上述(1)中D为NaClO、(2)中的D为SO2都能使品红溶液褪色,利用褪色后的溶液探究使品红溶液褪色的物质,取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色,
故答案为:取少量褪色后的溶液加热,若溶液恢复红色,则是SO2使品红褪色,若溶液不变红,则是NaClO使品红褪色.
点评 本题考查了物质转化关系、物质性质、反应现象和反应产物的判断等知识点,掌握基础是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案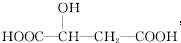
| A. | 苹果酸中能发生酯化反应的官能团有1种 | |
| B. | 1 mol苹果酸可与3 mol NaHCO3发生中和反应 | |
| C. | 1 mol苹果酸与足量金属 Na反应生成生成mol H2 | |
| D. | 1 mol苹果酸可以形成三元或四元环状内酯 |
| A. | Ba(OH)2 | B. | Na2O2 | C. | SiO2 | D. | Fe2O3 |
| A. | 金刚石跟石墨是同素异形体 | B. | 126C和146C是同位素 | ||
| C. | 不同的核素质子数可能相同 | D. | C2H4和C3H6一定是同系物 |
| A. | 乙醇和乙二醇互为同系物 | |
| B. | 异丙苯(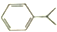 )分子中碳原子可能都处于同一平面 )分子中碳原子可能都处于同一平面 | |
| C. | 按系统命名法,化合物(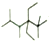 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 )的名称是2,3,5,5一四甲基一4,4一二乙基己烷 | |
| D. | 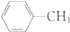 的一溴代物和 的一溴代物和 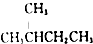 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) |
| A. | 100 mL 1 mol/L的盐酸中含HCl分子数为0.1NA | |
| B. | 7.8 g Na2O2和Na2S的混合物中阴离子数目为0.2NA | |
| C. | 标准状况下,2.24 L SO3中含有氧原子数目为0.3NA | |
| D. | 2 g D216O中含中子、质子、电子数目均为NA |