题目内容
7.在氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质.下列实验现象和结论一定正确的是( )| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在 | |
| B. | 向氯水中滴加石蕊试液,溶液先变红后褪色,说明溶液中有盐酸和次氯酸 | |
| C. | 加入盐酸酸化,再加入硝酸银溶液产生白色沉淀,说明氯水中有Cl-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在 |
分析 新制氯水中存在Cl2+H2O?H++Cl-+HClO,所含分子只有Cl2和H2O、HClO分子,所含的离子只有H+、Cl-、ClO-和OH-,结合对应离子的性质解答该题.
解答 解:A.氯水中含有次氯酸,可使有色布条褪色,故A错误;
B.氯气和水反应生成盐酸和次氯酸,其中H+可使石蕊变红,HClO可使石蕊褪色,故B正确;
C.加入盐酸,引入氯离子,不能确定氯水中含有Cl-,故C错误;
D.加入NaOH溶液,氯水浅黄绿色消失,是由于氯气和氢氧化钠溶液反应,与次氯酸无关,故D错误.
故选B.
点评 本题考查氯水的成分及氯水中各微粒的性质,为高频考点,侧重于学生的分析能力的考查,明确离子、分子的性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
9.将15.0gCu和Zn的混合物(内含少量不与硝酸反应的物质)与足量稀硝酸反应,假设还原产物只有NO气体,其体积在标准状况下为3.36L.将溶液稀释为500mL,测得溶液中c(H+)=0.2mol•L-1,此时溶液中NO3-的浓度为( )
| A. | 0.4mol•L-1 | B. | 0.6mol•L-1 | C. | 0.8mol•L-1 | D. | 1.1mol•L-1 |
15.下图是中学化学常见的实验操作,其中错误的是( )
| A. |  给液体加热 | B. |  除去CO中的CO2 | ||
| C. |  向试管中倾倒液体 | D. |  稀释浓硫酸 |
2.标准状况下,4.48L NH3的物质的量是( )
| A. | 20 mol | B. | 0.5 mol | C. | 0.2 mol | D. | 2 mol |
12.下列实验方法能达到实验目的是( )
| A. | 用分液漏斗从食醋中分离出乙酸 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH溶液除去Cl2中含有的少量HCl | |
| D. | 用KSCN溶液检验FeCl3溶液 中是否含有Fe3+ |
19.对于某些离子的检验及结论一定正确的是( )
| A. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| B. | 加入稀盐酸后产生无色无味的气体,将气体通入澄清石灰水,溶液变浑浊,原溶液一定含有CO32- | |
| C. | 加入硝酸银溶液有白色沉淀产生,一定有Cl- | |
| D. | 向某溶液中加入盐酸,无明显现象,再加入氯化钡溶液有白色沉淀产生,一定有SO42- |
16.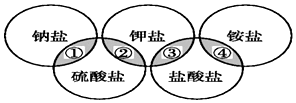 下列各项中的物质,能满足如图中阴影部分关系的是( )
下列各项中的物质,能满足如图中阴影部分关系的是( )
 下列各项中的物质,能满足如图中阴影部分关系的是( )
下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | NaCl | K2SO4 | KCl | NH4Cl |
| C | Na2SO4 | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A | B. | B | C. | C | D. | D |
17.下列有关溶液组成的描述合理的是( )
| A. | 在Fe2(SO4)3溶液中可以大量存在:K+、Cl-、Br-、ClO- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3- | |
| C. | 加水稀释时$\frac{c(O{H}^{-})}{c({H}^{+})}$值减小的溶液中可大量存在:MnO4-、CO32-、K+、NH4+ | |
| D. | 在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |