题目内容
20.采自地质深层的矿泉水常溶有岩石所含放射性物质在衰变过程中释放的氡,下列关于该类矿泉水说法正确的是( )| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |
分析 矿泉水中含有少量放射性物质,可适当存放一段时间,以免对人体有害,以此解答该题.
解答 解:矿泉水中含有少量放射性物质,可适当存放一段时间,并不是越鲜越号,以免对人体有害,深层开采矿泉水,放射性物质可能较多,只有B正确.
故选B.
点评 本题考查化学环境污染知识,为高频考点,侧重于化学与生活、生产以及环境的考查,有利于培养学生良好的科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列分类方法中正确的是( )
| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
8.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
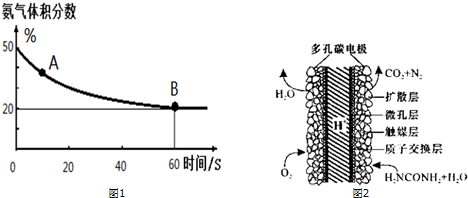
氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;(填具体数值)
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);

氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:
2NH3(g)+CO2(g)═NH2COONH4(s)
将实验测得的不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0 B.△H>0,△S<0
C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.
此时溶液中c(NH4+)=0.1mol/L;(填具体数值)
NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
15.二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
(1).用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H,在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)=0.03mol•L-1•min-1;计算该反应的平衡常数K=0.5625.
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是BC(填字母代号).
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.7kJ•mol-1.
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O.
(1).用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H,在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
v(N2)=0.03mol•L-1•min-1;计算该反应的平衡常数K=0.5625.
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是BC(填字母代号).
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.1kJ•mol-1
2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24.5kJ•mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=-122.7kJ•mol-1.
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O.
12.下列说法正确的是( )

| A. | 萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的 | |
| B. | 加热胆矾晶体使其失去结晶水,用图3装置 | |
| C. | 分离CCl4和I2的混合液,如图1和图2操作 | |
| D. | 蒸馏海水得到淡水,用图4装置 |
9.下列各项表述中正确的是( )
| A. | 氢氧燃料电池就是将氢气在氧气中燃烧,从而获得电流 | |
| B. | 46g的乙醇和28g的乙烯完全燃烧时消耗的O2均为为67.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数一定也为7 | |
| D. | Cl-的结构示意图为 |

 .
.