题目内容
17.下列分类方法中正确的是( )| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
分析 A、根据化合物的水溶液或熔融态能否导电判断电解质和非电解质;
B、酸性氧化物、碱性氧化物和两性氧化物的分类是依据氧化物的性质进行分类;
C、同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物;
D、分散系的分类依据是分散质微粒直径大小分析判断.
解答 解:A、根据化合物的水溶液或熔融态能否导电将化合物分为电解质和非电解质,故A错误;
B、依据氧化物性质把氧化为分为酸性氧化物、碱性氧化物和两性氧化物,故B错误;
C、同种元素组成的纯净物为单质,不同种元素组成的纯净物为化合物,根据组成元素的种类将纯净物分为单质和化合物,故C正确;
D、根据分散系分散质微粒直径将分散系分为溶液、胶体和浊液,故D错误;
故选C.
点评 本题考查电解质非电解质、分散系、氧化物等分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
7.下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
| A. | 6.72L CO | B. | 6.6gCO2 | C. | 8gSO3 | D. | 9.8gH2SO4 |
8.教材中用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
(1)用电离方程式表示草酸溶液显酸性的原因H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.
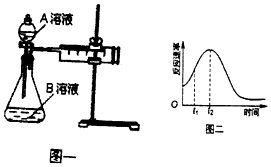
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.

2.以下对电子转移的方向和数目的表示正确的是( )
| A. | 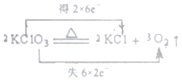 | B. |  | ||
| C. | 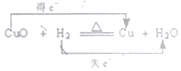 | D. |  |
20.采自地质深层的矿泉水常溶有岩石所含放射性物质在衰变过程中释放的氡,下列关于该类矿泉水说法正确的是( )
| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |