题目内容
16.如图转化关系中A-H为中学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体,已知单质乙、化合物A为黄色(或淡黄色)固体,乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程,B、F两种气体都能使澄清石灰水边浑浊(部分反应物或产物略去)
(1)写出物质A的电子式:
 .
.(2)写出下列物质的化学式:甲O2乙S丙Al.
(3)写出A与H2O溶液反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
丙与D溶液反应的化学方程式2Al+2NasOH+2H2O=2NaAlO2+3H2↑.
乙与D溶液反应的化学方程式3S+6NaOH=Na2SO4+2Na2S+3H2O.
(4)常温下,H可用丙材料的容器盛装的原因是铝在浓硫酸中表面形成致密的氧化膜,阻止内部金属的反应(或铝在浓硫酸中发生钝化).
分析 化合物A是淡黄色固体,能与水反应生成单质甲,可推知A为Na2O2,甲为O2,D为NaOH;B气体能使澄清石灰水变浑浊,其与过氧化钠反应生成氧气,可推知B为CO2、E为Na2CO3,单质乙为淡黄色固体,能与氧气反应生成气体F,且F能使澄清石灰水变浑浊,故乙为S、F为SO2,G为SO3,H为H2SO4;,单质丙能与氢氧化钠、硫酸反应生成单质丁,可推知丙为Al、丁为H2,以此解答该题.
解答 解:(1)A为Na2O2,电子式为 ,故答案为:
,故答案为: ;
;
(2)由以上分析可知甲为O2,乙为S,丙为Al,故答案为:O2;S;Al;
(3)A为Na2O2,与水反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,丙与D溶液反应是金属铝和氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NasOH+2H2O=2NaAlO2+3H2↑,乙为S,与NaOH溶液反应生成硫化钠、亚硫酸钠和水,反应的化学方程式为3S+6NaOH=Na2SO4+2Na2S+3H2O,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;2Al+2NasOH+2H2O=2NaAlO2+3H2↑;3S+6NaOH=Na2SO4+2Na2S+3H2O;
(4)常温下金属铝在浓硫酸中 发生钝化现象,在表面生成一层致密的氧化物膜,不再继续反应,则浓硫酸可用铝制容器盛放,
故答案为:铝在浓硫酸中表面形成致密的氧化膜,阻止内部金属的反应(或铝在浓硫酸中发生钝化);
点评 本题考查无机物推断,为高频考点,侧重考查学生的分析能力,物质的颜色及转化关系在特殊反应是推断突破口,需要学生熟练掌握元素化合物性质,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温下,1L 0.1mol/L HCl溶液中含氢原子数是0.1NA | |
| B. | 标准状况下,2.24L由CO2和O2组成的混合气体中含氧分子数是0.1NA | |
| C. | 10g碳酸钙与足量的稀盐酸充分反应消耗的氢离子数为0.1NA | |
| D. | 标准状况下,11.2L CO和 NO混合气体中与11.2LN2中分子数均为0.5NA |
7.下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
| A. | 6.72L CO | B. | 6.6gCO2 | C. | 8gSO3 | D. | 9.8gH2SO4 |
4.含有一个双键的烯烃和H2加成后的产物结构如图,则该烯烃的可能结构有( )种


| A. | 8 种 | B. | 7种 | C. | 6种 | D. | 5种 |
11.下列物质的性质及应用都正确的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 二氧化硅不与强酸反应,用玻璃器皿盛放氢氟酸 | |
| C. | 液氨气化时要吸收大量的热,可用作制冷剂 | |
| D. | 氯化铝是一种电解质,可用氯化铝电解制铝 |
1.下列离子方程式中,不正确的是( )
| A. | 高锰酸钾酸性溶液与草酸钾溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | KI的酸性溶液长期置于空气中::4I-+4H++O2═2I2+2H2O | |
| C. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 用食醋除去水垢:CO32-+2CH3COOH═H2O+CO2↑+2CH3COO- |
8.教材中用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
(1)用电离方程式表示草酸溶液显酸性的原因H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.
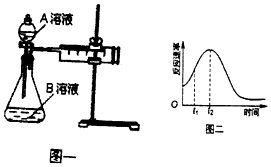
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.

20.采自地质深层的矿泉水常溶有岩石所含放射性物质在衰变过程中释放的氡,下列关于该类矿泉水说法正确的是( )
| A. | 该矿泉水越鲜越好 | |
| B. | 该矿泉水宜存放一段时间再用 | |
| C. | 鲜用和存放一段使用对人体危害是一样的 | |
| D. | 越深层开采矿泉水,污染程度越小 |
