题目内容
9.实验室中需要配制一种仅含四种离子(不包括水电离出的离子)的无色混合溶液,且在混合溶液中四种离子的物质的量浓度均为1mol•L-1.下面四个选项中能达到此目的是( )| A. | Na+、Cl-、SO42-、K+ | B. | K+、Cu2+、SO42-、NO3- | ||
| C. | K+、H+、HCO3-、Cl- | D. | Mg2+、Cl-、SO42-、Na+ |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,四种离子的物质的量浓度均为1mol•L-1,应遵循电荷守恒,并结合离子的颜色来解答.
解答 解:A.该组离子之间不反应,可大量共存,但不存在电荷守恒,故A不选;
B.Cu2+为蓝色,与无色不符,故B不选;
C.H+、HCO3-结合生成水和气体,不能共存,故C不选;
D.该组离子之间不反应,可大量共存,且遵循电荷守恒及离子均为无色,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法中不正确的是( )
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 纯碱可用于清洗油污 | |
| C. | 侯式制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O2 |
14.下列数量的物质中含对应微粒数目最多的是( )
| A. | 0.8molNaCl所含离子数 | B. | 标准状况下5.6L CO2所含原子数 | ||
| C. | 1L1 mol•L-1盐酸溶液所含H原子数 | D. | 10g氖气所含原子数 |
1.下列有关化学平衡移动叙述中正确的是( )
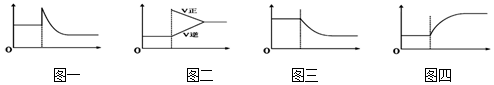

| A. | 可逆反应:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硫酸,溶液变橙色,氢离子浓度随时间变化曲线如图一 | |
| B. | 可逆反应Co(H2O)62+(粉红色)+4Cl-?CoCl42- (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如图二 | |
| C. | 可逆反应:2NO2?N2O4达平衡状态呈红棕色,加压红棕色变深,NO2物质的量随时间变化曲线如图三 | |
| D. | 可逆反应:N2(g)+3H2(g)?2NH3(g)△H<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如图四 |
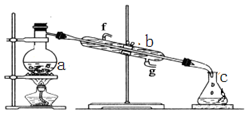
18.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)装置图1中A的名称是蒸馏烧瓶.A 中一般要加入碎瓷片,其作用是防暴沸.下列关于以上实验操作说法一定正确的是D
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险.
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出.
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度.
D.图4实验中,当加热至有较多固体析出时,即停止加热.
(2)现有一瓶A和B的混合液,已知它们的性质如表.
据此分析,将A和B相互分离可选用图中的图1所示仪器.

(1)装置图1中A的名称是蒸馏烧瓶.A 中一般要加入碎瓷片,其作用是防暴沸.下列关于以上实验操作说法一定正确的是D
A.图1实验中,加热一段时间后发现未加入碎瓷片,应马上添加,以防发生危险.
B.图2实验中,应打开活塞,将有机溶剂从下端导管中放出.
C.图3实验中,可以用玻璃棒在漏斗中搅拌,以加快过滤速度.
D.图4实验中,当加热至有较多固体析出时,即停止加热.
(2)现有一瓶A和B的混合液,已知它们的性质如表.
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
19.下列说法中错误的是( )
| A. | HCl、HBr、HI、HF的沸点依次升高 | |
| B. | 氨分子中N-H键的极性小于水分子中O-H键的极性 | |
| C. | 乙醇分子间存在氢键,乙醛分子间不存在氢键,故乙醇的沸点高于乙醛 | |
| D. | 由于N-H键强于P-H键,故NH3的沸点高于PH3 |