题目内容
20.下列有关NaClO和NaCl混合溶液的叙述正确的是( )| A. | 该溶液中,NH4+、Fe2+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、Ag+、H+、NO3-可以大量共存 | |
| C. | 向该溶液中通入SO2气体,反应的离子方程式为SO2+3CIO-+H2O═SO42-+CI-+2HCIO | |
| D. | 向该溶液中加入浓盐酸,反应的离子方程式为CIO-+CI-+2H+═Cl2↑+H2O |
分析 A.次氯酸根离子能够氧化亚铁离子、溴离子;
B.银离子与氯离子生成氯化银沉淀、次氯酸根离子与氢离子生成次氯酸;
C.若二氧化硫足量,次氯酸根离子完全转化成氯离子;
D.酸性条件下次氯酸根离子与氯离子反应生成氯气.
解答 解:A.NaClO能够氧化Fe2+、Br-,在溶液中不能大量共存,故A错误;
B.Ag+、Cl-反应生成氯化银沉淀,NaClO与H+反应,在溶液中不能大量共存,故B错误;
C.向该溶液中通入SO2气体,需要根据二氧化硫的量分析,若二氧化硫不足时的离子方程式为:SO2+3ClO-+H2O═SO42-+Cl-+2HClO,若二氧化硫过量,反应离子方程式为:SO2+ClO-+H2O═SO42-+Cl-+2H+,故C错误;
D.向该溶液中加入浓盐酸,二者反应生成氯气,反应的离子方程式为:ClO-+Cl-+2H+═Cl2↑+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11. 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100ml容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
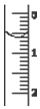
(3)读取盛装0.1000mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
Ⅲ.数据处理与讨论
(1)按实验所得数据,可得c(市售白醋)=0.75mol•L-1;市售白醋总酸量=4.5g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).Ⅰ.实验步骤
(1)配制100mL待测白醋溶液:用酸式滴定管(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100ml容量瓶(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴酚酞作指示剂.
(3)读取盛装0.1000mol•L-1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为0.60mL.
(4)滴定.当溶液由无色恰好变为红色,并在半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
Ⅱ.实验记录
| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
(1)按实验所得数据,可得c(市售白醋)=0.75mol•L-1;市售白醋总酸量=4.5g•100mL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是ab填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
8.已知Ksp(Ag2S)=1.6×10-49,Ksp(CuS)=8.9×10-35,Ksp(Sb2S3)=1.0×10-30.某溶液中含有Ag+、Cu2+和Sb3+,浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1的Na2S溶液时,三种阳离子产生沉淀的先后顺序为( )
| A. | Ag+、Cu2+、Sb3+ | B. | Cu2+、Ag+、Sb3+ | C. | Sb3+、Ag+、Cu2+ | D. | Ag+、Sb3+、Cu2+ |
5.可用分液漏斗分离的一组混合物是( )
| A. | 硝基苯和酒精 | B. | 溴苯和溴 | C. | 甲苯和苯 | D. | 硝基苯和水 |
12.下列指定微粒的个数比等于2:1的是( )
| A. | ${\;}_{1}^{2}$H原子中的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数与中子数 | |
| C. | ${\;}_{4}^{8}$Be2+中的质子数和电子数 | |
| D. | ${\;}_{12}^{26}$Mg2+中的中子数和电子数 |
10.化学与生活、能源、环科技等密切相关.下列描述错误的是( )
| A. | 在厨房里用米汤不能直接检验食盐中是否含有碘 | |
| B. | 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
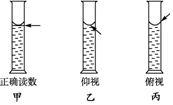 在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.
在配制一定物质的量浓度溶液的实验中,用量筒去取用一定量的浓溶液.量液时,量筒必须放平,视线要跟量筒内液体的凹液面最低点保持水平(如图甲),再读出液体的体积数.