题目内容
15.现有X、Y、Z三种常见非金属元素,A、B、C三种常见金属元素,已知有如下情况:①X、Y、Z的单质在常温下均为气体.
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色.
③XZ极易溶于水,XZ的水溶液可使石蕊试液变红.
④2mol X的单质可与1mol Y的单质化合生成2mol X2Y,X2Y常温下为液体.
⑤Z的单质溶于X2Y中所得溶液具有漂白性
⑥A的单质可以在Z的单质中燃烧,生成棕黄色固体,该固体溶于水呈棕黄色溶液.
⑦B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成.
⑧C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色.
请完成下列问题:
(1)写出下列物质化学式:XZHCl,BZ2CuCl2.
(2)Z的单质溶于X2Y中所得溶液中起漂白作用的物质是HClO(化学式).
(3)A的单质与Z的单质反应的化学方程式2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)C的单质与Y单质反应生成淡黄色物质的化学方程式2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2.
(5)Z单质与NaOH溶液反应的离子方程式2OH-+Cl2=Cl-+ClO-+H2O.
分析 X、Y、Z的单质在常温下均为气体,X单质的摩尔质量是所有常见气体中最小的,Z单质呈黄绿色.则X为H,Z为Cl,X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ易溶于水,XZ的水溶液可使石蕊试液变红.则XZ是HCl,2mol X的单质可与1mol Y的单质化合生成2mol X2Y,X2Y常温下为液体.则Y是O,Z的单质溶于X2Y中所得溶液是盐酸与次氯酸,次氯酸具有漂白性.A的单质可以在Z的单质中燃烧,生成棕褐色固体,该固体溶于水呈棕黄色溶液.则A为Fe,B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成.则B为Cu,C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色.则C为Na.由以上分析可知,XZ为HCl,X2Y为H2O,BZ2为CuCl2,结合物质的性质解答该题.
解答 解:X、Y、Z的单质在常温下均为气体,X单质的摩尔质量是所有常见气体中最小的,Z单质呈黄绿色.则X为H,Z为Cl,X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色,XZ易溶于水,XZ的水溶液可使石蕊试液变红.则XZ是HCl,2mol X的单质可与1mol Y的单质化合生成2mol X2Y,X2Y常温下为液体.则Y是O,Z的单质溶于X2Y中所得溶液是盐酸与次氯酸,次氯酸具有漂白性.A的单质可以在Z的单质中燃烧,生成棕褐色固体,该固体溶于水呈棕黄色溶液.则A为Fe,B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成.则B为Cu,C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色.则C为Na.由以上分析可知,XZ为HCl,X2Y为H2O,BZ2为CuCl2,
(1)XZ为HCl,BZ2为CuCl2,故答案为:HCl;CuCl2;
(2)Cl的单质溶于H2O中反应生成HCl和HClO,其中HClO具有漂白性,故答案为:HClO;
(3)Fe在Cl2中燃烧生成,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(4)Na在O2中燃烧生成淡黄色的Na2O2,反应的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,故答案为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;
(5)在NaOH中自身发生氧化还原反应生成NaCl、NaClO和水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,离子方程式为2OH-+Cl2=Cl-+ClO-+H2O,故答案为:2OH-+Cl2=Cl-+ClO-+H2O.
点评 本题考查无机物的推断,题目难度中等,本题主要根据物质反应的典型现象作为突破口,学习中注意相关基础知识的积累.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | Na2CO3、H2SO4、HCl、NaNO3 | B. | NaOH、NaCl、K2SO4、FeCl3 | ||
| C. | HCl、AgNO3、HNO3、MgCl2 | D. | K2SO4、Na2CO3、BaCl2、HNO3 |
 化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是
化合物A、B、C、D中均含有短周期元素X,B是一种常见的单质,它们有如图5所示的转化关系(部分产物与反应条件已略去),下列说法正确的是( )
| A. | X元素可能是金属,也可能是非金属 | |
| B. | 反应①、②、③均为氧化还原反应 | |
| C. | 反应②、③为可逆反应 | |
| D. | 若B为金属单质,反应①的“一定条件”为电解时,通常加入冰晶石作为助溶剂 |
| A. | c(K+)+c(H+)═c(OH-)+c(HS-)+2 c(S2-) | B. | c(K+)>c(HS-)>c(OH-)>c(H+) | ||
| C. | c(HS-)+c(S2-)+c(H2S)=0.1 mol•L-1 | D. | c(K+)>c(HS-)>c(H+)>c(OH-) |
| A. | 该溶液中,NH4+、Fe2+、SO42-、Br-可以大量共存 | |
| B. | 该溶液中,K+、Ag+、H+、NO3-可以大量共存 | |
| C. | 向该溶液中通入SO2气体,反应的离子方程式为SO2+3CIO-+H2O═SO42-+CI-+2HCIO | |
| D. | 向该溶液中加入浓盐酸,反应的离子方程式为CIO-+CI-+2H+═Cl2↑+H2O |
| 选项 | 实验 | 现象 | 结论 |
| A | 25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液 | KMnO4溶液紫红色褪去 | 乙烯具有还原性 |
| C | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
| D | 向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液 | 固体由白色逐渐变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |

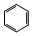 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$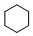
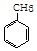 +3HO-NO2$→_{△}^{浓硫酸}$
+3HO-NO2$→_{△}^{浓硫酸}$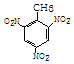 +3H2O,反应类型取代反应
+3H2O,反应类型取代反应 .
. .
.