题目内容
下列离子方程式正确的是( )
| A、将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、向碳酸氢钠溶液中滴加过量的氢氧化钡:2HCO3-+Ba2++2OH-═BaCO3↓+H2O+CO32- |
| D、向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.铁离子具有氧化性,能够与碘离子反应氧化还原反应生成亚铁离子和碘单质;
B.次氯酸具有强氧化性,能够将二氧化硫氧化成硫酸根离子;
C.氢氧化钡过量,离子方程式按照碳酸氢钠的组成书写,反应产物中不会有碳酸根离子;
D.亚铁离子的还原性大于溴离子,氯气不足,亚铁离子优先被氯气氧化.
B.次氯酸具有强氧化性,能够将二氧化硫氧化成硫酸根离子;
C.氢氧化钡过量,离子方程式按照碳酸氢钠的组成书写,反应产物中不会有碳酸根离子;
D.亚铁离子的还原性大于溴离子,氯气不足,亚铁离子优先被氯气氧化.
解答:
解:A.将氢氧化铁粉末加入氢碘酸中,反应生成亚铁离子、碘单质和水,正确的离子方程式为:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A错误;
B.次氯酸钙溶液中通入少量二氧化硫,离子方程式按照二氧化硫书写,反应生成硫酸钙、次氯酸、氢离子和氯离子,正确的离子方程式为:Ca2++ClO-+H2O+SO2═CaSO4↓+2H++Cl-,故B错误;
C.向碳酸氢钠溶液中滴加过量的氢氧化钡,反应产物中不会有碳酸根离子剩余,正确的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C错误;
D.溴化亚铁溶液中通入少量氯气,亚铁离子优先被氧化,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
B.次氯酸钙溶液中通入少量二氧化硫,离子方程式按照二氧化硫书写,反应生成硫酸钙、次氯酸、氢离子和氯离子,正确的离子方程式为:Ca2++ClO-+H2O+SO2═CaSO4↓+2H++Cl-,故B错误;
C.向碳酸氢钠溶液中滴加过量的氢氧化钡,反应产物中不会有碳酸根离子剩余,正确的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,故C错误;
D.溴化亚铁溶液中通入少量氯气,亚铁离子优先被氧化,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选D.
点评:本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
同体积的1molL-1的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg.下列叙述中正确的是( )
| A、HNO3、HCl、H2SO4中放出H2的速率相同 |
| B、HCl、HNO3中放出H2的量相等 |
| C、HCl、CH3COOH中放出H2的量相等 |
| D、H2SO4中放出H2的量最多,其余的相等 |
下列离子方程式中,正确的是( )
A、水玻璃中通入足量的CO2:Si
| ||
| B、氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||
| C、NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O | ||
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- |
 图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)?2Z(g)+W(s)的过程.下列说法不正确的是( )
图中曲线分别表示相同温度下,压强为P1、P2条件下发生可逆反应:mX(g)+nY(g)?2Z(g)+W(s)的过程.下列说法不正确的是( )| A、P1>P2 |
| B、m+n=2 |
| C、m+n=3 |
| D、P1、P2下平衡常数相同 |
下列说法中不正确的是( )
| A、Na2CO3比NaHCO3易溶于水 |
| B、相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,Na2CO3放出CO2多 |
| C、Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀 |
| D、相同物质的量的Na2CO3和NaHCO3分别与足量盐酸反应得CO2的物质的量之比为1:1 |
对于质量相同的CH4和O2,下列说法正确的是( )
| A、所含分子个数相等 |
| B、物质的量相等 |
| C、所含原子个数之比为5:1 |
| D、体积之比为2:1 |




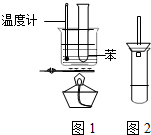 某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)
某学生为验证苯的沸点(80.1℃)比水低,设计了如图1所示的实验装置:(某些固定装置已略去)