题目内容
对于质量相同的CH4和O2,下列说法正确的是( )
| A、所含分子个数相等 |
| B、物质的量相等 |
| C、所含原子个数之比为5:1 |
| D、体积之比为2:1 |
考点:阿伏加德罗定律及推论
专题:计算题
分析:A.根据根据N=nNA=
NA确定分子数多少;
B.根据n=
知,相同质量时,二者的物质的量之比等于其摩尔质量的反比;
C.根据其分子个数之比再结合分子构成确定原子个数之比;
D.只有气体摩尔体积相等时,二者才能根据V=nVm确定其体积关系.
| m |
| M |
B.根据n=
| m |
| M |
C.根据其分子个数之比再结合分子构成确定原子个数之比;
D.只有气体摩尔体积相等时,二者才能根据V=nVm确定其体积关系.
解答:
解:A.根据N=nNA=
NA知,相同质量时,二者的分子个数之比等于其摩尔质量的反比,为32g/mol:16g/mol=2:1,故A错误;
B.根据n=
知,相同质量时,二者的物质的量之比等于其摩尔质量的反比,为32g/mol:16g/mol=2:1,故B错误;
C.根据A知,二者的分子个数之比为2:1,结合其分子构成知,其原子个数之比=(2×5):(1×2)=5:1,故C正确;
D.温度和压强未知无法计算二者体积大小,故D错误;
故选C.
| m |
| M |
B.根据n=
| m |
| M |
C.根据A知,二者的分子个数之比为2:1,结合其分子构成知,其原子个数之比=(2×5):(1×2)=5:1,故C正确;
D.温度和压强未知无法计算二者体积大小,故D错误;
故选C.
点评:本题考查了阿伏伽德罗定律及其推论,灵活运用物质的量公式是解本题关键,注意气体摩尔体积的适用范围及适用条件.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、加入铝粉产生H2 的溶液中:Fe2+、Na+、SO2-4、ClO- |
| B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO-3 |
| C、c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、Cl- |
| D、使甲基橙呈红色的溶液:K+、Cl-、SO2-4、S2O2-3 |
在一定条件下,在一固定体积的密闭容器中进行下列反应:N2(g)+3H2(g)?2NH3(g),下列能说明反应已达平衡状态标志的是( )
| A、断裂1molN≡N键,同时生成6molN-H键 |
| B、V(H2)=V(NH3)=3:2 |
| C、混合气体的密质不再发生改变 |
| D、容器内混合气体的平均相对分子质量不再发生改变 |
下列离子方程式正确的是( )
| A、将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、向碳酸氢钠溶液中滴加过量的氢氧化钡:2HCO3-+Ba2++2OH-═BaCO3↓+H2O+CO32- |
| D、向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
设阿伏加德罗常数的值为NA,下列有关说法正确的是( )
| A、0.5mol苯分子中含有C=C双键数为1.5NA |
| B、2.8g乙烯、丙烯和聚乙烯的混合物中所含碳原子数为0.2NA |
| C、标准状况下,2.24L C5H12含有的共用电子对为1.6NA |
| D、1mol甲基(-CH3)所含的电子总数为8NA |
下列叙述中正确的是( )
| A、1mol氢的质量是1g |
| B、1mol CO的质量为28g?mol-1 |
| C、2mol O的质量为16g |
| D、3.01×1023个SO2分子的物质的量为0.5mol |
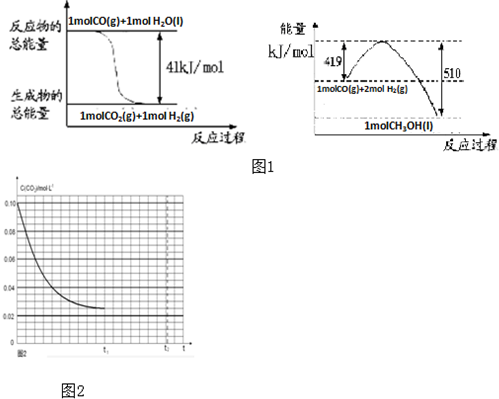
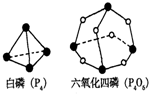 化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )
化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;现提供以下化学键的键能:P-P 198KJ?mol-1、P-O 360kJ?mol-1、O=O 498kJ?mol-1.则关于1mol P4和3mol O2完全反应(P4+3O2=P4O6)的热效应说法正确的是( )| A、该反应是吸热反应且吸收热量1638 kJ |
| B、该反应是放热反应且放出热量1638 kJ |
| C、该反应反应物的内能低于产物内能 |
| D、该反应反应物的键能之和高于产物键能之和 |
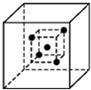 金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )| A、12,大立方体的12条棱的中点 |
| B、8,大立方体的8个顶角 |
| C、6,大立方体的6个面的中心 |
| D、14,大立方体的8个顶角和6个面的中心 |