题目内容
同体积的1molL-1的HCl、H2SO4、CH3COOH、HNO3分别加入过量的Mg.下列叙述中正确的是( )
| A、HNO3、HCl、H2SO4中放出H2的速率相同 |
| B、HCl、HNO3中放出H2的量相等 |
| C、HCl、CH3COOH中放出H2的量相等 |
| D、H2SO4中放出H2的量最多,其余的相等 |
考点:弱电解质在水溶液中的电离平衡,镁的化学性质
专题:电离平衡与溶液的pH专题,元素及其化合物
分析:稀盐酸、稀硫酸和醋酸与镁反应都生成氢气,稀硝酸和锌反应生成氮的化合物不生成氢气,醋酸是弱酸在溶液中部分电离,其氢离子的浓度小于酸的浓度;HCl在溶液中完全电离,其氢离子的浓度等酸的浓度,H2SO4在溶液中完全电离,其氢离子的浓度等于酸的浓度的2倍.
解答:
解:A、B稀硝酸和镁反应生成氮的化合物不生成氢气,故A、B错误;
C、HCl、CH3COOH的浓度相同,体积相同,则两种酸的物质的量相同,而且均为一元酸,与过量的Mg反应生成的氢气的量相同,故C正确;
D、硫酸为二元酸,则其氢离子的浓度等于酸的浓度的2倍,所以硫酸放出的氢气最多,稀硝酸和镁反应生成氮的化合物不生成氢气,故D错误.
故选C.
C、HCl、CH3COOH的浓度相同,体积相同,则两种酸的物质的量相同,而且均为一元酸,与过量的Mg反应生成的氢气的量相同,故C正确;
D、硫酸为二元酸,则其氢离子的浓度等于酸的浓度的2倍,所以硫酸放出的氢气最多,稀硝酸和镁反应生成氮的化合物不生成氢气,故D错误.
故选C.
点评:本题考查了酸和金属的反应,明确酸的氧化性强弱、同浓度同体积的酸和足量金属反应生成氢气多少的因素即可解答,注意硝酸和浓硫酸与锌反应都不产生氢气,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
肯定不会影响化学平衡的因素是( )
| A、温度 | B、浓度 | C、压强 | D、催化剂 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、加入铝粉产生H2 的溶液中:Fe2+、Na+、SO2-4、ClO- |
| B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO-3 |
| C、c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、Cl- |
| D、使甲基橙呈红色的溶液:K+、Cl-、SO2-4、S2O2-3 |
既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是( )
| A、通入足量的酸性高锰酸钾溶液 |
| B、与足量的溴水反应 |
| C、点燃 |
| D、在一定条件下与氢气加成 |
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ |
| B、已知C(石墨,s)═C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2则△H1>△H2 |
| D、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol |
下列说法正确的是( )
| A、形成离子键的阴阳离子间只存在静电吸引力 |
| B、第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| C、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| D、原子及其离子的核外电子层数等于该元素所在的周期数 |
在一定条件下,在一固定体积的密闭容器中进行下列反应:N2(g)+3H2(g)?2NH3(g),下列能说明反应已达平衡状态标志的是( )
| A、断裂1molN≡N键,同时生成6molN-H键 |
| B、V(H2)=V(NH3)=3:2 |
| C、混合气体的密质不再发生改变 |
| D、容器内混合气体的平均相对分子质量不再发生改变 |
下列离子方程式正确的是( )
| A、将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、向碳酸氢钠溶液中滴加过量的氢氧化钡:2HCO3-+Ba2++2OH-═BaCO3↓+H2O+CO32- |
| D、向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |
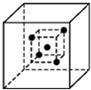 金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )
金刚石是由碳原子所形成的正四面体结构向空间无限延伸而得到的具有空间网状结构的原子晶体.在立方体中,若一碳原子位于立方体中心,则与它直接相邻的四个碳原子位于该立方体互不相邻的四个顶角上(如图中的小立方体).请问,图中与小立方体顶角的四个碳原子直接相邻的碳原子数为多少,它们分别位于大立方体的什么位置( )| A、12,大立方体的12条棱的中点 |
| B、8,大立方体的8个顶角 |
| C、6,大立方体的6个面的中心 |
| D、14,大立方体的8个顶角和6个面的中心 |