题目内容
向100mL 0.1mol/L醋酸溶液中加入下列物质,混合溶液有关量或性质变化趋势正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加水稀释促进CH3COOH电离,CH3COOH电离增大程度小于溶液体积增大程度;
B.向CH3COOH溶液中加入NaOH固体,氢氧根离子和氢离子反应生成水,从而促进CH3COOH电离,当CH3COOH完全电离后,醋酸根离子的物质的量最大;
C.向CH3COOH溶液中通入HCl气体,氯化氢电离出的氢离子抑制CH3COOH电离;
D.溶液导电能力与自由移动离子浓度成正比.
B.向CH3COOH溶液中加入NaOH固体,氢氧根离子和氢离子反应生成水,从而促进CH3COOH电离,当CH3COOH完全电离后,醋酸根离子的物质的量最大;
C.向CH3COOH溶液中通入HCl气体,氯化氢电离出的氢离子抑制CH3COOH电离;
D.溶液导电能力与自由移动离子浓度成正比.
解答:
解:A.加水稀释促进CH3COOH电离,CH3COOH电离增大程度小于溶液体积增大程度,所以随着加入水量的增大,溶液中氢离子浓度逐渐减小,当溶液接近中性时,氢离子浓度接近10-7 mol/L,故A错误;
B.向CH3COOH溶液中加入NaOH固体,氢氧根离子和氢离子反应生成水,从而促进CH3COOH电离,当CH3COOH完全电离后,n(CH3COO-)最大,继续加入NaOH固体时,n(CH3COO-)不变,故B正确;
C.向CH3COOH溶液中通入HCl气体,氯化氢电离出的氢离子抑制CH3COOH电离,但CH3COOH电离程度不能为0,故C错误;
D.溶液导电能力与自由移动离子浓度成正比,向溶液中加入醋酸钠固体,溶液中C(CH3COO-)增大,抑制醋酸电离,但溶液中自由离子浓度增大,溶液的导电能力增大,所以其导电能力不能减小,故D错误;
故选B.
B.向CH3COOH溶液中加入NaOH固体,氢氧根离子和氢离子反应生成水,从而促进CH3COOH电离,当CH3COOH完全电离后,n(CH3COO-)最大,继续加入NaOH固体时,n(CH3COO-)不变,故B正确;
C.向CH3COOH溶液中通入HCl气体,氯化氢电离出的氢离子抑制CH3COOH电离,但CH3COOH电离程度不能为0,故C错误;
D.溶液导电能力与自由移动离子浓度成正比,向溶液中加入醋酸钠固体,溶液中C(CH3COO-)增大,抑制醋酸电离,但溶液中自由离子浓度增大,溶液的导电能力增大,所以其导电能力不能减小,故D错误;
故选B.
点评:本题考查了弱电解质的电离,根据加入物质对醋酸电离的影响、溶液中各离子浓度变化分析解答,注意D中溶液导电能力与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
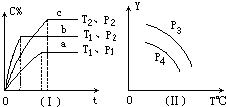 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)?xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)?xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是( )| A、p3>p4,Y轴表示A的质量 |
| B、p3>p4,Y轴表示混合气体平均摩尔质量 |
| C、p3>p4,Y轴表示混合气体密度 |
| D、p3<p4,Y轴表示B的百分含量 |
肯定不会影响化学平衡的因素是( )
| A、温度 | B、浓度 | C、压强 | D、催化剂 |
下列各对物质中,不是互为同系物的是( )
A、环己烷与  |
B、 和 和 |
| C、甲苯和二甲苯 |
| D、乙酸和硬脂酸 |
下列反应不属于置换反应的是( )
| A、CuO+H2=Cu+H2O |
| B、C+2CuO=2Cu+CO2↑ |
| C、Fe2O3+3CO=2Fe+3CO2 |
| D、Fe+CuCl2=Cu+FeCl2 |
镁带在空气中燃烧生成的固体产物主要是氧化镁和氮化镁.将燃烧后的固体产物溶解在60mL浓度为2.0mol/L的盐酸中,(氮化镁和盐酸反应的化学方程式为:Mg3N2+8HCl═3MgCl2+2NH4Cl)以20mL 0.5mol/L的氢氧化钠溶液中和多余的盐酸,然后在此溶液中加入过量的碱,把氨全部蒸发出来,用稀盐酸吸收,稀盐酸增重0.17g.镁带的质量为( )
| A、0.6 g |
| B、1.2 g |
| C、2.4 g |
| D、3.6 g |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、加入铝粉产生H2 的溶液中:Fe2+、Na+、SO2-4、ClO- |
| B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO-3 |
| C、c(H+)/c(OH-)=1012的溶液中:NH+4、Al3+、NO-3、Cl- |
| D、使甲基橙呈红色的溶液:K+、Cl-、SO2-4、S2O2-3 |
既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是( )
| A、通入足量的酸性高锰酸钾溶液 |
| B、与足量的溴水反应 |
| C、点燃 |
| D、在一定条件下与氢气加成 |
下列离子方程式正确的是( )
| A、将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、向次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| C、向碳酸氢钠溶液中滴加过量的氢氧化钡:2HCO3-+Ba2++2OH-═BaCO3↓+H2O+CO32- |
| D、向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- |