题目内容
NA表示阿伏伽德罗常数,下列说法正确的是( )
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.14g氮气的物质的量为:
=0.5mol;
B.50 mL1 mol/L的Na2SO4溶液中含有溶质硫酸钠0.05mol,含有0.1mol钠离子;
C.标况下22.4L混合气体的物质的量为1mol;
D.镁为2价金属,24g镁的物质的量为1mol,1mol镁与足量盐酸反应生成2mol电子.
| 14g |
| 28g/mol |
B.50 mL1 mol/L的Na2SO4溶液中含有溶质硫酸钠0.05mol,含有0.1mol钠离子;
C.标况下22.4L混合气体的物质的量为1mol;
D.镁为2价金属,24g镁的物质的量为1mol,1mol镁与足量盐酸反应生成2mol电子.
解答:
解:A.14g氮气的物质的量为0.5mol,含有的分子数为0.5NA,故A正确;
B.50 mL1 mol/L的Na2SO4溶液中含有溶质硫酸钠的物质的量为0.05mol,0.05mol硫酸钠中含有0.1mol钠离子,含Na+数为0.1NA,故B错误;
C.标准状况下,22.4L氢气和氧气的物质的量为1mol,所含分子数为NA,故C正确;
D.24g镁的物质的量为1mol,1mol镁完全反应失去2mol电子,转移电子数为2NA,故D错误;
故选AC.
B.50 mL1 mol/L的Na2SO4溶液中含有溶质硫酸钠的物质的量为0.05mol,0.05mol硫酸钠中含有0.1mol钠离子,含Na+数为0.1NA,故B错误;
C.标准状况下,22.4L氢气和氧气的物质的量为1mol,所含分子数为NA,故C正确;
D.24g镁的物质的量为1mol,1mol镁完全反应失去2mol电子,转移电子数为2NA,故D错误;
故选AC.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
 如图表示反应X(g)?4Y(g)+Z(g),△H<O,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
如图表示反应X(g)?4Y(g)+Z(g),△H<O,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )| A、第6min后,反应就终止了 |
| B、X的平衡转化率为85% |
| C、第1-5min内,X的平均反应速率为0.1mol/(L?s) |
| D、第6-8min内,各物质的浓度之比为1:4:1 |
已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为0.1mol/(L?min),则此段时间内以C的浓度变化表示的化学反应速率为( )
| A、0.5 mol/(L?min) |
| B、0.1 mol/(L?min) |
| C、0.2 mol/(L?min) |
| D、0.3 mol/(L?min) |
有甲、乙、丙三种试液,在氢氧化钡溶液中加入甲有白色沉淀生成,在沉淀中加入乙,沉淀完全溶解并产生气泡,最后向所得溶液中加入丙又产生白色沉淀,则甲、乙、丙依次是( )
| A、K2CO3、HCl、CaCl2 |
| B、Na2CO3、HNO3、MgSO4 |
| C、Na2CO3、HCl、Ba(NO3)2 |
| D、H2SO4、Na2CO3、AgNO3 |
下列变化中,加入还原剂可以实现的是( )
| A、Cu2+→Cu |
| B、SO2→SO3 |
| C、HCl→Cl2 |
| D、NO→NO2 |
下列离子方程式书写正确的是( )
A、向苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO
| ||
| B、用硫酸铜溶液除去乙炔中的硫化氢气体:Cu2++S2-=CuS↓ | ||
C、乙酸与碳酸钙溶液反应:2CH3COOH+CO
| ||
| D、酸性高锰酸钾溶液中通入乙炔后紫色褪去:2MnO4-+6H++C2H2=2Mn2++2CO2+4H2O |
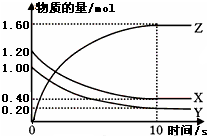 (1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则