题目内容
3.次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物A.经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A中各元素的原子个数相等;A的主要化学性质如下:①温度超过60℃,分解成金属铜和一种气体;
②在氯气中着火;
③与盐酸反应放出气体.
(1)A的化学式为CuH
(2)A的生成反应方程式为4CuSO4+3H3PO2+6H2O=4CuH+3H3PO4+4H2SO4.
分析 A是一红棕色难溶物质,温度超过60℃,分解生成红色金属铜和一种气体,在一定条件下可以用H3PO2与CuSO4溶液混合制备A,
A中各元素的原子个数相等,将A与盐酸反应也同样产生气体.A可以在氯气中燃烧,可知A为CuH,据此回答即可.
解答 解:A是一红棕色难溶物质,温度超过60℃,分解生成红色金属铜和一种气体,在一定条件下可以用H3PO2与CuSO4溶液混合制备A,
A中各元素的原子个数相等,将A与盐酸反应也同样产生气体.A可以在氯气中燃烧,可知A为CuH,
(1)由以上分析可知A为CuH,故答案为:CuH;
(2)H3PO2与CuSO4溶液混合,Cu被还原,则H3PO2被氧化,氧化产物为H3PO4,其反应方程式为:4CuSO4+3H3PO2+6H2O=4CuH+3H3PO4+4H2SO4;
故答案为:4CuSO4+3H3PO2+6H2O=4CuH+3H3PO4+4H2SO4.
点评 本题考查无机物推断,侧重于元素化合物知识的综合理解和运用的考查,需要学生熟练掌握元素化合物知识,题目难度不大.

练习册系列答案
相关题目
5.下列物质中,Cl-的浓度为3mol•L-1的是( )
| A. | 150mL,1mol•L-1 的NaCl | B. | 100mL,2mol•L-1 的MgCl2 | ||
| C. | 100mL,1mol•L-1 的FeCl3 | D. | 50mL,3mol•L-1 的FeCl2 |
11.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L NO2溶于水完全反应转移电子数为0.2NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氢原子数为0.6NA的乙烯分子中含有的π键数为0.2NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
8.下列关于价电子构型3s23p4的描述正确的是( )
| A. | 该元素的电负性是同主族最大的 | |
| B. | 其轨道表示式为 | |
| C. | 可以与H2化合生成液态化合物 | |
| D. | 它的核外电子排布式为1s22s22p63s23p4 |
15.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
湿法制备的主要反应方程为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
干法制备的主要反应方程为:2FeSO4+4Na2O2═2Na2FeO4+2Na2SO4
下列有关说法不正确的是( )
| A. | 高铁酸钾中铁显+3价 | |
| B. | 湿法中每生成1mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1mol Na2FeO4转移4 mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质 |
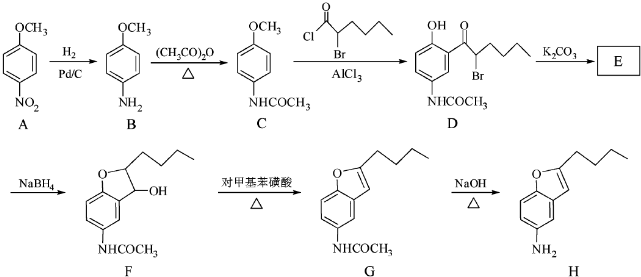
 +CH3COOH
+CH3COOH .
.