题目内容
19.一定条件下反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志是( )| A. | 单位时间内生成n mol AB的同时生成n mol的B2 | |
| B. | 容器内的总压强不随时间而变化 | |
| C. | 2v(A2)正=v(AB)逆 | |
| D. | A2、B2、AB的反应速率之比为1:1:2的状态 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、平衡时应有单位时间内生成2n mol AB的同时生成n mol的B2,故A错误;
B、两边气体的计量数相等,所以容器内压强始终保持不变,故B错误;
C、2v(A2)正=v(AB)正=v(AB)逆,故C正确;
D、只要反应发生就有A2、B2、AB的反应速率之比为1:1:2的状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
19.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解 释 |
| A | 用含有铁粉的透气小袋与食品一起密封包装 | 利用铁粉的吸水性 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是两性氧化物,能溶于氢氟酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | “忽闻海上有仙山,山在虚无缥缈间”描述了海市蜃楼现象 | 是一种自然现象,与胶体知识有关 |
| A. | A | B. | B | C. | C | D. | D |
20.《四川盐法志》记载了煮盐的过程,当煮盐近于饱和时,往卤水中点加豆汁,至“渣滓皆浮聚于面,用瓢舀出,再入豆汁二三次,至渣净水澄,蒸干即可得盐”.下列叙述正确的是( )
| A. | 煮盐的过程属于化学变化 | B. | 豆汁的主要成分为淀粉 | ||
| C. | 利用豆汁产生的泡沫除杂 | D. | 加入豆汁可以降低NaCl溶解度 |
14. 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:
试完成下列问题:
(1)填出图中实验仪器的名称A环形玻璃搅拌棒,B碎泡沫.
(2)实验时用A搅拌溶液的方法是上下搅动.不能用铜丝搅拌棒代替A的理由是铜传热快,防止热量损失.
(3)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].
(4)若将HCl溶液改为相同体积、相同浓度的醋酸,测得中和热为△H1=-Q KJ/mol,则Q与57.3的关系为:Q<57.3(填“<”、“>”或“=”),理由是醋酸边反应边电离,醋酸电离吸热.
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)填出图中实验仪器的名称A环形玻璃搅拌棒,B碎泡沫.
(2)实验时用A搅拌溶液的方法是上下搅动.不能用铜丝搅拌棒代替A的理由是铜传热快,防止热量损失.
(3)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].
(4)若将HCl溶液改为相同体积、相同浓度的醋酸,测得中和热为△H1=-Q KJ/mol,则Q与57.3的关系为:Q<57.3(填“<”、“>”或“=”),理由是醋酸边反应边电离,醋酸电离吸热.
4.下列反应能用化合直接制得的是( )
①FeCl2 ②FeCl3 ③Fe(OH)2 ④Fe(OH)3⑤Cu2S.
①FeCl2 ②FeCl3 ③Fe(OH)2 ④Fe(OH)3⑤Cu2S.
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | 全部 |
11.下列有关实验能成功的是( )
| A. | 苯加入到溴水中,将会和溴发生取代反应而使溴水褪色 | |
| B. | 在空气中灼烧铜丝,待铜丝冷却后伸入乙醇中,反复多次,可以制得乙醛 | |
| C. | 在洁净的试管中加入1~2mL的AgNO3溶液,再滴加稀氨水,直到AgOH完全沉淀,即制得银氨溶液 | |
| D. | 将10%的葡萄糖溶液加入新制氢氧化铜溶液中,加热可得到砖红色沉淀 |
8.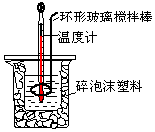 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
(1)在该实验中,量取50mL 盐酸或NaOH 溶液,需要用到的玻璃仪器量简和胶头滴管.
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失.
(3)某同学实验记录的数据如表所示,其中记录的终止温度是指完全反应后混合溶液的最高温度.
(4)计算该实验发生中和反应时放出的热量为1.31kJ(中和后生成的溶液的比热容c=4.18J/(g•℃).
(5)如果用50mL 0.55mol/L的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少.
 用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.
用50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液,在如图所示的装置中进行中和反应.测定强酸与强碱反应的反应热.| 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是减少实验过程中的热量损失.
(3)某同学实验记录的数据如表所示,其中记录的终止温度是指完全反应后混合溶液的最高温度.
(4)计算该实验发生中和反应时放出的热量为1.31kJ(中和后生成的溶液的比热容c=4.18J/(g•℃).
(5)如果用50mL 0.55mol/L的氨水(NH3•H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是一水合氨为弱电解质,反应过程中电离需要吸收热量,故放出的热量偏少.
9.如图W、X、Y、Z为四种物质,若箭头表示能一步转化的反应,则符合常温下能实现图示转化关系的是( )
| 选项 | W | X | Y | Z | 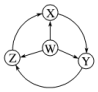 |
| A | Cl2 | FeCl2 | FeCl3 | HClx|k.Com] | |
| B | Na | Na2O2 | NaOH | NaCl | |
| C | NH3 | NO2 | HNO3 | NO | |
| D | Al | AlCl3 | NaAlO2 | Al2(SO4)3 |
| A. | A | B. | B | C. | C | D. | D |
