题目内容
14. 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)填出图中实验仪器的名称A环形玻璃搅拌棒,B碎泡沫.
(2)实验时用A搅拌溶液的方法是上下搅动.不能用铜丝搅拌棒代替A的理由是铜传热快,防止热量损失.
(3)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].
(4)若将HCl溶液改为相同体积、相同浓度的醋酸,测得中和热为△H1=-Q KJ/mol,则Q与57.3的关系为:Q<57.3(填“<”、“>”或“=”),理由是醋酸边反应边电离,醋酸电离吸热.
分析 (1)为充分的反应,用环形玻璃棒搅拌棒;碎泡沫的作用是保温、隔热、减少热量损失;为充分的反应,用环形玻璃棒搅拌棒;
(2)环形玻璃搅拌棒上下搅动使溶液充分反应;金属导热快,热量损失多;
(3)根据公式Q=cm△T来求出生成0.05mol的水放出热量,最后根据中和热的概念求出反应热;
(4)根据弱电解质电离吸热.
解答 解:(1)实验仪器A的名称为环形玻璃搅拌棒,用于搅拌溶液,使之充分反应;实验仪器B的名称为碎泡沫,是为了保温、隔热、减少热量损失;
故答案为:环形玻璃搅拌棒;碎泡沫;
(2)环形玻璃搅拌棒上下搅动使溶液充分反应;不能将环形玻璃搅拌棒改为铜丝搅拌棒,因为铜丝搅拌棒是热的良导体,
故答案为:上下搅动;铜传热快,防止热量损失;
(3)50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液的质量和m=100mL×1g/mL=100g,c=4.18J/(g•℃),t2-t1=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为$\frac{1.4212kJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:-56.8kJ/mol;
(4)醋酸为弱酸,电离过程为吸热过程,所以将HCl溶液改为相同体积、相同浓度的醋酸,反应放出的热量小于57.3kJ,所以Q<57.3;
故答案为:<;醋酸边反应边电离,醋酸电离吸热.
点评 本题考查中和热的测定,明确实验装置及装置中各部分的作用、实验注意事项即可解答,题目难度不大.

 字词句段篇系列答案
字词句段篇系列答案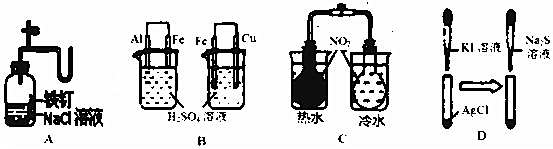
| 实验 | 实验现象 | 结论 |
| A | 广口瓶中光亮的铁钉放置一段时间后生锈 | 铁钉发生析氢腐蚀 |
| B | 左烧杯铁表面冒气泡,右烧杯铜表面冒气泡 | 金属活动性:Al>Fe>Cu |
| C | 左烧杯气体颜色加深,右烧杯气体颜色变浅 | 2NO2(g)?N2O4(g)△H>0 |
| D | 白色固体先变为黄色,后变为黑色 | Ksp:AgCl<AgI<Ag2S |
| A. | A | B. | B | C. | C | D. | D |
| A. | 用湿润的pH试纸测定溶液的pH,测定结果偏小,该溶液一定呈酸性 | |
| B. | 用pH试纸分别测定氯水和盐酸的pH值,比较两溶液的酸性强弱 | |
| C. | 取同体积不同浓度的醋酸和盐酸加水稀释相同倍数,测定稀释前后pH值的变化,以此区别这两种酸 | |
| D. | 测定硫酸型酸雨的pH值时,取样后应立即测定 |
| A. | 单位时间内生成n mol AB的同时生成n mol的B2 | |
| B. | 容器内的总压强不随时间而变化 | |
| C. | 2v(A2)正=v(AB)逆 | |
| D. | A2、B2、AB的反应速率之比为1:1:2的状态 |
| A. | 硝酸具有还原性 | B. | 光导纤维的主要成分是二氧化硅 | ||
| C. | 次氯酸是一种强酸 | D. | 钠的焰色为浅紫色 |
| A. | 进行萃取操作时,应选择有机萃取剂,且萃取剂的密度要比水大 | |
| B. | 进行蒸馏操作时,应使温度计的水银球靠近蒸馏烧瓶的瓶口处 | |
| C. | 进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 进行蒸发操作时,应将蒸发皿中溶液蒸干后,再停止加热 |
| A. | Na2SO3溶液使酸性高锰酸钾溶液褪色:5SO32-+6H++2MnO4-=5SO42-+2Mn2++3H2O | |
| B. | 铵明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca 2++2HCO 3 -+2OH -=BaCO 3↓+CO 3 2- 十2H 2 O | |
| D. | 弱酸尼泊金酸( 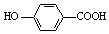 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: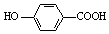 +HCO3-→ +HCO3-→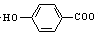 -+CO2↑+H2O -+CO2↑+H2O |

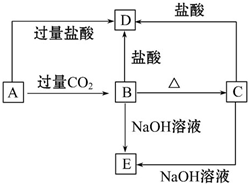 A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.
A、B、C、D、E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,已知A中含钾元素.