题目内容
4.下列反应能用化合直接制得的是( )①FeCl2 ②FeCl3 ③Fe(OH)2 ④Fe(OH)3⑤Cu2S.
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | 全部 |
分析 化合反应指的是由两种或两种以上的物质生成一种新物质的反应;
①铁和氯化铁反应生成的是氯化亚铁;
②铁和氯气反应生成的是氯化铁;
③Fe(OH)2不能用化合反应直接制得;
④氢氧化亚铁和氧气、水反应生成氢氧化铁;
⑤铜和硫反应生成的是Cu2S.
解答 解:化合反应的概念是由两种或两种以上的物质生成一种新物质
①铁和氯化铁反应生成的是氯化亚铁,反应方程式为:Fe+2FeC13=3FeC12,故①正确;
②铁和氯气反应生成的是氯化铁,反应方程式为:2Fe+3C12=2FeC13,故②正确;
③Fe(OH)2不能用化合反应直接制得,故③错误;
④可以实现,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,故④正确;
⑤铜和硫反应生成的是Cu2S,反应方程式为:2Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$Cu2S,故⑤正确;
故选A.
点评 本题以化合反应为载体考查元素化合物的性质,为高频考点,侧重考查学生的分析能力和元素化合物知识的综合理解和运用,注意根据化合反应概念来分析解答即可,难度不大.

练习册系列答案
相关题目
4.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )

| A. | c点对应的溶液中大量存在的离子可能为:NH4+、Ba2+、Cl-、I- | |
| B. | a点对应的溶液中水的电离程度可能大于c点对应的溶液中水的电离程度 | |
| C. | 将25℃时的NaCl溶液加热到T℃,则该溶液中的c(OH-)由b点变化到e点 | |
| D. | bd线上的任意一点均有pH=7 |
5.W、X、Y、Z均为短周期主族原子,原子序数依次增大,其原子的最外层电子数之和为18,W和Y同主族,X原子的电子层数与最外层电子数相等,Z元素最高正价与最低负价的绝对值之差为6,下列说法不正确的是( )
| A. | W的一种单质的沸点比X的高 | |
| B. | 氧化物的水化物的酸性:Z>W | |
| C. | W与Y可形成一种硬度很大的化合物 | |
| D. | W、X、Y三种元素均可以与Z元素形成共价化合物 |
12.下列关于过滤的叙述正确的是( )
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
19.一定条件下反应A2(g)+B2(g)?2AB(g)达到平衡状态的标志是( )
| A. | 单位时间内生成n mol AB的同时生成n mol的B2 | |
| B. | 容器内的总压强不随时间而变化 | |
| C. | 2v(A2)正=v(AB)逆 | |
| D. | A2、B2、AB的反应速率之比为1:1:2的状态 |
16.下列物质的方程式正确的是( )
| A. | H2O3?2H++CO32- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | BaOH)2?Ba2++2OH- |
13.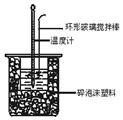 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )| A. | 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| C. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 | |
| D. | 实验中应记录测量出的最高温度 |

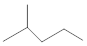 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.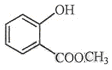 中含氧的官能团的名称为羟基,酯基.
中含氧的官能团的名称为羟基,酯基.