题目内容
8.用电子式表示下列过程:①MgCl2的形成过程

②H2O的形成过程
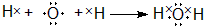 .
.
分析 ①MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到;
②氢原子和氧原子之间以共用电子对而形成水分子.
解答 解:①MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为: ,
,
故答案为: ;
;
②H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为: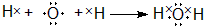 ,
,
故答案为: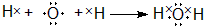 .
.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3-)+2 c(SO32-)+c(H2SO3) | |
| C. | 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1 | |
| D. | 20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
19.X、Y、Z、W为短周期的四种元素,有关它们的部分信息如表所示:
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X单质的电子式是 .
.
(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3.
(3)W、Z形成的化合物的水溶液的pH<(填“>”“<”或“=”)7,理由是Al3++3H2O?Al(OH)3+3H+ (用离子方程式表示).
(4)8g Y的最简单氢化物完全燃烧生成液态水时放出445kJ的热量,写出Y的最简单氢化物的燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1.
| 元素 | 部分信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 |
| Z | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 地壳中含量最多的金属元素 |
(1)X单质的电子式是
 .
.(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3.
(3)W、Z形成的化合物的水溶液的pH<(填“>”“<”或“=”)7,理由是Al3++3H2O?Al(OH)3+3H+ (用离子方程式表示).
(4)8g Y的最简单氢化物完全燃烧生成液态水时放出445kJ的热量,写出Y的最简单氢化物的燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1.
16.下列实验装置(固定装置略去)和操作正确的是( )
| A. |  除去CO中的CO2 | B. |  酸碱中和滴定 | ||
| C. |  中和热测定 | D. |  实验室制取乙酸乙酯 |
3.常温下,在某密闭容器中充入a摩尔H2S和b摩尔SO2,测得反应后溶器内压强为反应前的一半,则a:b为( )
| A. | 1:2 | B. | 2:3 | C. | 4:5 | D. | 5:1 |
13.下列各组离子在指定溶液中,可能大量共存的是( )
| A. | 加入铝能放出H2的溶液中:NH4+、Na+、Cl-、Br- | |
| B. | 水电离出的c(H+)=10-13mol•L-1的溶液中:Fe3+、K+、CO32-、SO32- | |
| C. | 室温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol•L-1的溶液中:Al3+、Na+、SiO32-、HCO3- | |
| D. | 使石蕊变红的溶液中:Fe2+、K+、ClO-、SO42- |
17.下列属于碱的是( )
| A. | SO2 | B. | H2SiO3 | C. | Na2CO3 | D. | NaOH |
5.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )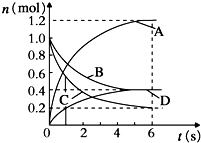

| A. | 该反应的化学方程式为3B+4D?6A+2C | |
| B. | 反应进行到1s时,v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的反应速率相等 | |
| D. | 反应进行到6s时,B的平均反应速率为0.05mol/(L•s) |