题目内容
4.1mol某烃最多能和2mol HBr加成,且产物最多能与8mol Cl2发生取代反应,则该烃可能为( )| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH3-CH=CH2 |
分析 气态烃1mol最多可与2molHBr加成,说明分子中含有2个C=C或1个C≡C键,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8mol Cl2,说明加成产物含有8个H,其中有2个H为与HBr加成生成,则原烃中含有H为6,可用排除法解答该题.
解答 解:某气态烃1mol最多和2mol HBr发生加成反应,说明分子中含有1个C≡C或2个C=C键,所得产物又能与8mol氯气发生取代反应,说明加成产物中含有8个H原子,则该气态烃应含有6个H原子,
A.乙烯的分子式为C2H4,分子中含4个氢原子,不符合条件,故A错误;
B.丙炔分子式为C3H4,H原子数不符合,故B错误;
C.CH2═CH-CH═CH2分子中含有两个碳碳双键,且含有6个H,满足条件,故C正确;
D.丙烯分子式为C3H6,含有1个碳碳双键,不满足条件,故D错误;
故选C.
点评 本题考查有机物分子式确定的计算,题目难度中等,注意熟练掌握常见有机物结构与性质,明确取代反应与加成反应实质的实质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.化学与社会可持续发展密切相关.下列做法不合理的是( )
| A. | 将废旧电池集中深埋,防止重金属污染 | |
| B. | 改善能源结构,大力发展太阳能、风能等清洁能源 | |
| C. | 推广碳捕集和转化成化工原料技术,逐步实现二氧化碳零排放 | |
| D. | 采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质 |
12.战国所著《周礼》中记载沿海古人“煤饼烧砺房成灰”(“砺房”即牡蜗壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | Na2CO3 | C. | SiO2 | D. | CaCO3 |
9. 过氧乙酸(
过氧乙酸(  )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水.
②不断搅拌并控制B中混合液的温度为20~30℃一段时间.
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品.
不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见表),请回答相关问题:
(1)C仪器中冷水流入口是a(填a或b),生成过氧乙酸的化学方程式是CH3COOH+H2O2$\frac{\underline{\;浓硫酸\;}}{\;}$CH3COOOH+H2O.
(2)反应物最佳比例($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)是1:1,反应所需时间约5(选填1、3、5、7)小时.
(3)为更好控制反应温度,应增加的措施是B用带温度计的水浴控温.
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率.
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d.0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒.
你选泽的试剂及器材是a、f、g(选填序号)实验方案是试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间).
(5)产品含量测定.
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KmnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液.该样品中过氧乙酸的物质的量浓度是6.6mol/L.
 过氧乙酸(
过氧乙酸(  )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水.
②不断搅拌并控制B中混合液的温度为20~30℃一段时间.
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品.
不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见表),请回答相关问题:
| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(2)反应物最佳比例($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)是1:1,反应所需时间约5(选填1、3、5、7)小时.
(3)为更好控制反应温度,应增加的措施是B用带温度计的水浴控温.
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率.
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d.0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒.
你选泽的试剂及器材是a、f、g(选填序号)实验方案是试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间).
(5)产品含量测定.
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KmnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液.该样品中过氧乙酸的物质的量浓度是6.6mol/L.
13.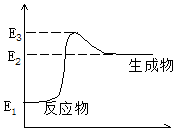 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )| A. | 减小压强时,Q的值增大 | B. | 升高温度时,Q的值减小 | ||
| C. | 该反应是吸热反应 | D. | Q=E3-E1 |
14.下列有关化学与生产、生活的说法正确的是( )
| A. | 医学上可用碳酸钡代替硫酸钡用作“钡餐” | |
| B. | 生理盐水用于医疗输液是因为它属于强电解质 | |
| C. | 医学上用液氮作制冷剂是因为液氮的沸点很低 | |
| D. | 水中的钢闸门连接电源负极,利用了牺牲阳极的阴极保护法 |
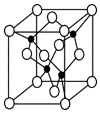 X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题:
X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题: .
. .
.
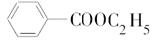 .
.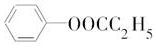 .
.