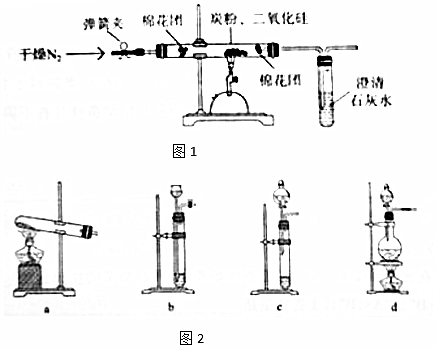
题目内容
9. 过氧乙酸(
过氧乙酸(  )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水.
②不断搅拌并控制B中混合液的温度为20~30℃一段时间.
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品.
不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见表),请回答相关问题:
| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(2)反应物最佳比例($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)是1:1,反应所需时间约5(选填1、3、5、7)小时.
(3)为更好控制反应温度,应增加的措施是B用带温度计的水浴控温.
(4)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率.
可供选择的试剂和器材有:a.过氧乙酸溶液;b.1mol/L的FeCl3溶液;c.0.5mol/L的Fe2(SO4)3溶液;d.0.5mol/L的CuCl2溶液;e.1mol/L的CuSO4溶液;f.计时器;g.测量气体体积的针筒.
你选泽的试剂及器材是a、f、g(选填序号)实验方案是试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间).
(5)产品含量测定.
取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KmnO4溶液至恰好粉红色,以除去残余H2O2,加入10mL10%溶液和几滴淀粉溶液,摇匀,用0.1000mol/L的Na2S2O3标准液达到至终点(反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),共消耗13.20mL,Na2S2O3标准液.该样品中过氧乙酸的物质的量浓度是6.6mol/L.
分析 (1)仪器C为冷凝管,采用逆流冷凝;冰醋酸与过氧化氢在浓硫酸催化生成过氧乙酸;
(2)根据表中数据对比分析;
(3)控制反应温度,需要温度计和水浴加热;
(4)比较Fe3+、Cu2+对过氧乙酸的催化效率,选择相同浓度的Fe3+、Cu2+对相同过氧乙酸反应的生成气体的时间快慢作比较.为减小误差,选择等浓度的Fe3+、Cu2+盐溶液,且阴离子相同,故选择Fe2(SO4)3溶液和Imol/L的CuSO4溶液,据此分析;
(5)根据关系式:CH3COOOH~I2~2Na2S2O3,据此计算稀释后5mL反应中n(CH3COOOH),进而计算原试样中过氧乙酸的质量分数.
解答 解:(1)器C为冷凝管,作用是冷凝蒸汽,采用逆流冷凝,冷水从a口通入;冰醋酸与过氧化氢在浓硫酸催化生成过氧乙酸,反应为:CH3COOH+H2O2$\frac{\underline{\;浓硫酸\;}}{\;}$CH3COOOH+H2O;
故答案为:a;CH3COOH+H2O2$\frac{\underline{\;浓硫酸\;}}{\;}$CH3COOOH+H2O;
(2)由表中数据可知($\frac{C{H}_{3}COOH}{{H}_{2}{O}_{2}}$)为1:1时,相同的反应时间下生成过氧乙酸含量(%)较高;此时随着反应时间的增加,产量增大,超过5小时,时间增加,产量增加的不多,故选择5小时最佳;
故答案为:1:1;5;
(3)反应需要温度,则需要温度计,为了较好的控制温度,需要水浴控温,故B用带温度计的水浴控温;
故答案为:B用带温度计的水浴控温;
(4)比较Fe3+、Cu2+对过氧乙酸的催化效率,选择相同浓度的Fe3+、Cu2+对相同过氧乙酸反应的生成气体的时间快慢作比较.为减小误差,选择等浓度的Fe3+、Cu2+盐溶液,且阴离子相同,故选择Fe2(SO4)3溶液和Imol/L的CuSO4溶液,方法为:试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5 mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间);
故答案为:c e;试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5 mol/L的Fe2(SO4)3溶液(或c)和Imol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间);
(5)过氧乙酸氧化碘离子:CH3COOOH+2H++2I-=I2+CH3COOH+H2O,又2Na2S2O3+I2═Na2S4O6+2NaI,可以得关系式如下:CH3COOOH~I2~2Na2S2O3,由关系式可知,n(CH3COOOH)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.1000mol/L×0.01320L=6.6×10-4mol,故原样品中w(CH3COOOH)=$\frac{6.6×1{0}^{-4}mol×\frac{100mL}{5mL}}{2mL×1{0}^{-3}}$=6.6mol/L;
故答案为:6.6mol/L.
点评 本题考查物质的制备、氧化还原反应滴定、实验原理的分析、实验方案设计多步反应关系的计算等,掌握实验仪器和实验方法是解题关键,注意计算,难度中等.

| A. |  n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体 | |
| B. |  n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 | |
| C. |  n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 | |
| D. |  n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物 |
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH3-CH=CH2 |
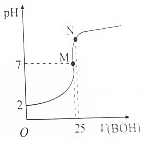 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )| A. | BA溶液呈碱性 | |
| B. | 酸HA的电离常数约为0.0011 | |
| C. | M点时,c(B+)=c(A-)>c(H+)=c(OH-) | |
| D. | N点时加入10mL0.1000mol•L-1HA溶液,将促进A-的水解 |
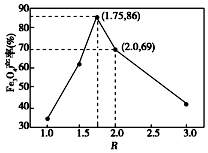
已知:步骤⑤中,相同条件下测得Fe3O4的产率与R(R=$\frac{n(\stackrel{+3}{Fe})}{n(\stackrel{+2}{Fe})}$)的关系如图所示.
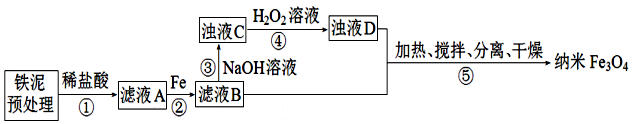
(1)为提高步骤①的反应速率,可采取的措施是搅拌、适当升高温度.
(2)步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+.
(3)常温下Fe3+、Fe2+以氢氧化物形式完全沉淀时溶液的pH如图.该温度下Ksp[Fe(OH)3]=1.0×10-38
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素
(5)⑤反应的离子方程式为2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O;步骤⑤中的“分离”包含的步骤有过滤、洗涤.
(6)设浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b.为使Fe3O4的产率最高,则$\frac{a}{b}$=0.636.(填数值,小数点后保留3位)
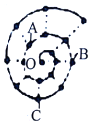 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )| A. | O与A、B、C均能形成两种化合物 | |
| B. | A元素位于元素周期表ⅥA族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | B、C最高价氧化物的水化物可以相互反应 |
| A. | 醋酸纤维属于酯类 | |
| B. | 顺-2-丁烯与反-2-丁烯的沸点不同 | |
| C. | 脱氧核糖核酸(DNA)是高分子有机物 | |
| D. | 由苯酚与溴水的反应可知,苯环影响了羟基 |