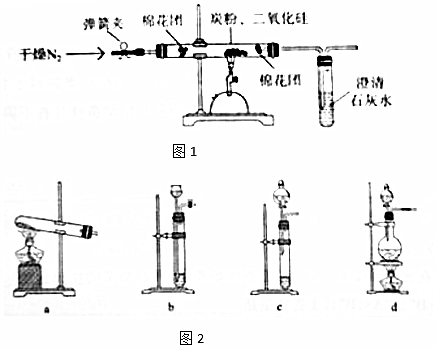
题目内容
12.战国所著《周礼》中记载沿海古人“煤饼烧砺房成灰”(“砺房”即牡蜗壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )| A. | CaO | B. | Na2CO3 | C. | SiO2 | D. | CaCO3 |
分析 牡蛎壳为贝壳,贝壳主要成分为碳酸钙,碳酸钙灼烧生成氧化钙,据此分析解答.
解答 解:“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”,牡蛎壳为贝壳,贝壳主要成分为碳酸钙,碳酸钙灼烧生成氧化钙,所以“蜃”主要成分是氧化钙,
故选:A.
点评 本题考查了物质的成分,明确贝壳主要成分及碳酸钙受热分解性质及产物即可解答,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.取ag某可燃物在氧气中完全燃烧,将其产物通过足量的过氧化钠固体充分吸收,反应后固体的质量增加了bg,满足a>b的是( )
| A. | H2 | B. | HCOOH | C. | C6H12O6 | D. | C12H22O11 |
20.下列图象能表示相关反应中生成物物质的量的变化的是(横、纵坐标单位:mol)( )
| A. | 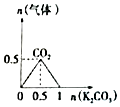 n (HCl)=1mol,K2CO3加入到HCl溶液中,在敝口容器中生成的气体 | |
| B. | 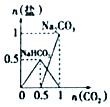 n(NaOH)=1mol,CO2通入到NaOH溶液中反应生成的盐 | |
| C. | 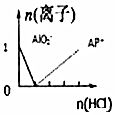 n(NaAlO2)=1mol,HCl加入到NaAlO2溶液中离子的存在情况 | |
| D. | 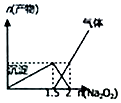 n(AlCl3)=1mol,Na2O2加入AlCl3溶液反应的产物 |
7.下列有关环境问题的说法正确的是( )
①臭氧的体积分数越大的空气越有利于人体健康
②煤燃烧时加入适量的石灰石,可减少废气中SO2的量
③PH在5.6~7.0之间的降水通常称为酸雨
④汽车尾气中含有氮氧化物、碳氧化物、含铅化合物等,严重污染大气.
①臭氧的体积分数越大的空气越有利于人体健康
②煤燃烧时加入适量的石灰石,可减少废气中SO2的量
③PH在5.6~7.0之间的降水通常称为酸雨
④汽车尾气中含有氮氧化物、碳氧化物、含铅化合物等,严重污染大气.
| A. | ①③ | B. | ①④ | C. | ③④ | D. | ②④ |
4.1mol某烃最多能和2mol HBr加成,且产物最多能与8mol Cl2发生取代反应,则该烃可能为( )
| A. | CH2=CH2 | B. | CH≡C-CH3 | C. | CH2=CH-CH=CH2 | D. | CH3-CH=CH2 |
1.某学习小组用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备Fe3O4纳米材料的流程示意图如下: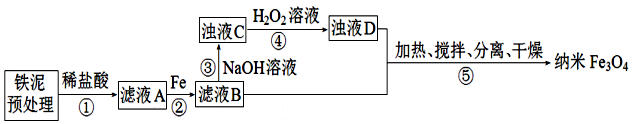
已知:步骤⑤中,相同条件下测得Fe3O4的产率与R(R=$\frac{n(\stackrel{+3}{Fe})}{n(\stackrel{+2}{Fe})}$)的关系如图所示.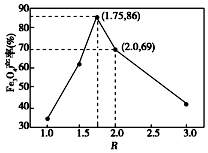
(1)为提高步骤①的反应速率,可采取的措施是搅拌、适当升高温度.
(2)步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+.
(3)常温下Fe3+、Fe2+以氢氧化物形式完全沉淀时溶液的pH如图.该温度下Ksp[Fe(OH)3]=1.0×10-38
(4)浊液D中铁元素以FeOOH形式存在.步骤④中,反应的化学方程式是2Fe(OH)2+H2O2=2FeOOH+2H2O;
步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素
(5)⑤反应的离子方程式为2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O;步骤⑤中的“分离”包含的步骤有过滤、洗涤.
(6)设浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b.为使Fe3O4的产率最高,则$\frac{a}{b}$=0.636.(填数值,小数点后保留3位)

已知:步骤⑤中,相同条件下测得Fe3O4的产率与R(R=$\frac{n(\stackrel{+3}{Fe})}{n(\stackrel{+2}{Fe})}$)的关系如图所示.

(1)为提高步骤①的反应速率,可采取的措施是搅拌、适当升高温度.
(2)步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+.
(3)常温下Fe3+、Fe2+以氢氧化物形式完全沉淀时溶液的pH如图.该温度下Ksp[Fe(OH)3]=1.0×10-38
| 沉淀物 | Fe(OH)3 | Fe(OH)2 |
| 完全沉淀物PH | 3.0 | 8.3 |
步骤④中,反应完成后需再加热一段时间除去剩余H2O2目的是加热使其分解除去,防止其在步骤⑤中继续氧化+2价铁元素
(5)⑤反应的离子方程式为2FeOOH+Fe2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+2H2O;步骤⑤中的“分离”包含的步骤有过滤、洗涤.
(6)设浊液D中FeOOH的物质的量为a,滤液B中的铁元素的物质的量为b.为使Fe3O4的产率最高,则$\frac{a}{b}$=0.636.(填数值,小数点后保留3位)
2.在一密闭容器中进行反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g).已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L.当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.8mol/L,O2为0.4 mol/L | B. | SO2为0.5 mol/L | ||
| C. | SO3为0.8 mol/L | D. | SO2、SO3均为0.3 mol/L |
 (1)已知在常温常压下:
(1)已知在常温常压下: