题目内容
15.向5.8g某饱和一元醛中加入足量的银氨溶液,在一定条件下充分反应后析出21.6g银,该醛是( )| A. | CH3CHO | B. | CH3CH2CHO | C. | CH3COCH3 | D. | CH3CH2CH2CHO |
分析 根据选项可知该醛不是甲醛,然后结合银氨反应中饱和一元醛n(醛):n(银)=1:2计算出醛的物质的量,然后根据M=$\frac{m}{n}$计算出该醛的摩尔质量,从而可知该醛的相对分子质量,最后结合饱和一元醛的通式计算即可.
解答 解:21.6g银的物质的量为:n(Ag)=$\frac{21.6g}{108g/mol}$=0.2mol,
结合选项可知该醛一定不是甲醛,在银氨反应中饱和一元醛醛n(醛):n(银)=1:2,则5.8g该醛的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,该醛的摩尔质量为:M=$\frac{5.8g}{0.1mol}$=58g/mol,
则该饱和一元醛的相对分子质量58,饱和一元醛的通式为CnH2nO,
则:14n+16=58,
解得:n=3,
所以该醛为丙醛,结构简式为:CH3CH2CHO,
故选B.
点评 本题考查了化学方程式的计算,题目难度中等,明确银镜反应原理为解答关键,注意掌握常见有机物结构与性质,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.把7.2g铁粉投入40ml某HNO3溶液中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol,若不考虑N2O4的存在,则原HNO3溶液的物质的量浓度( )
| A. | 3.5 mol/L | B. | 4.5 mol/L | C. | 7.0 mol/L | D. | 9.0 mol/L |
20.下列实验中能证明某气体为SO2的是( )
①使澄清石灰水变浑浊
②使湿润的蓝色石蕊试纸变红
③使品红溶液褪色
④通入足量NaOH溶液中,再滴加BaC12溶液,有白色沉淀生成,该沉淀溶于稀盐酸.
①使澄清石灰水变浑浊
②使湿润的蓝色石蕊试纸变红
③使品红溶液褪色
④通入足量NaOH溶液中,再滴加BaC12溶液,有白色沉淀生成,该沉淀溶于稀盐酸.
| A. | 只有④能证明 | B. | 都不能证明 | C. | ③④均能证明 | D. | 都能证明 |
7.下列关于苯的叙述不正确的是( )
| A. | 苯是无色、带有特殊气味的液体 | |
| B. | 苯分子中键与键的夹角是120° | |
| C. | 苯在一定条件下能与溴发生取代反应 | |
| D. | 苯中不含碳碳双键,所以不可能发生加成反应 |
4.化学与生产和生活、军事、科研产品紧密相关,下列说法不正确的是( )
| A. | 在牙膏中添加Na2PO3F、NaF或SrF2等均能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的 | |
| B. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤的方法除去 | |
| C. | 家用“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| D. | 可用蘸取浓盐酸的玻璃棒检验输送氨气的管道是否漏气 |
5.已知某链状高分子化合物结构简式为: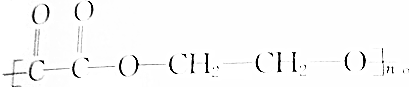 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
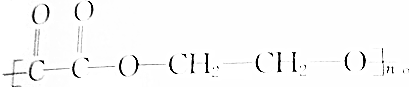 ,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )
,1mol该物质与足量NaOH溶液反应,消耗NaOH的物质的量为( )| A. | 2mol | B. | 4mol | C. | 2nmol | D. | 4nmol |
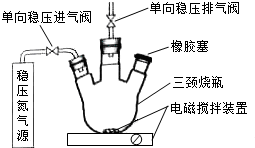 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg•L-1.我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg•L-1.某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO. .
.