题目内容
在0.5mol Na2SO4中含氧原子的数目为( )
| A、3.01×1023 |
| B、2 |
| C、1.204×1024 |
| D、0.5 |
考点:物质的量的相关计算
专题:
分析:根据化学式为Na2SO4,利用硫酸钠的物质的量来确定氧原子的物质的量,再利用N=n×NA来计算钠离子的数目.
解答:
解:0.5molNa2SO4中氧原子的物质的量为0.5mol×4=2mol,
则由N=n×NA可知,则氧原子的个数为2mol×6.02×1023mol-1=1.204×1024,
故选C
则由N=n×NA可知,则氧原子的个数为2mol×6.02×1023mol-1=1.204×1024,
故选C
点评:本题考查有关阿伏伽德罗常数的计算,比较基础,关键是确定物质与所含微粒关系,注意对公式的理解与应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质是电解质的是( )
| A、NaCl | B、酒精 |
| C、铜丝 | D、稀硫酸 |
下列化合物中只含有2个手性碳原子的是( )
A、 |
B、 |
C、 |
D、 |
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为( )
| A、3:1 | B、2:1 |
| C、1:1 | D、1:3 |
下列解释事实的离子方程式正确的是( )
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、实验室盛碱液的瓶子不用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| C、碳酸氢镁和足量的氢氧化钙溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| D、向Ca(ClO)2溶液中通入过量CO2:2ClO-+H2O+CO2═2HClO+CO32- |
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A、还原性:X的氢化物>Y的氢化物>Z的氢化物 |
| B、简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
| C、YX2、M2Y都是含有极性键的共价化合物 |
| D、Z元素的最高价氧化物的水化物的化学式为HZO4 |
下列微粒中,跟NH4+的电子总数和质子总数都相同的是( )
| A、Ne |
| B、F- |
| C、H3O+ |
| D、CH4 |
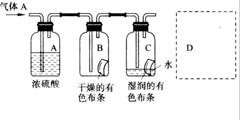 某学生用如图所示的方法研究物质的性质,其中气体A的主要成分,杂质是空气和水蒸气,回答下列问题:
某学生用如图所示的方法研究物质的性质,其中气体A的主要成分,杂质是空气和水蒸气,回答下列问题: