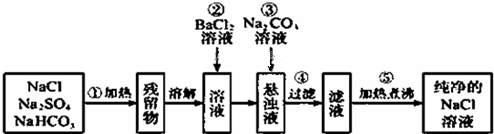
题目内容
以下是反应:2SO2+O2
2SO3在不同条件下达到平衡状态时SO2的转化率.
试回答下列问题.
(1)关于可逆反应的限度,你能得出什么启示? .
(2)提高该化学反应限度的途径有: .
(3)要实现SO2的转化率为93.5%,需控制的反应条件是 .
| 催化剂 |
| △ |
 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.5% | 89.5% | 96.4% |
(1)关于可逆反应的限度,你能得出什么启示?
(2)提高该化学反应限度的途径有:
(3)要实现SO2的转化率为93.5%,需控制的反应条件是
考点:化学平衡的调控作用
专题:化学平衡专题
分析:该反应为可逆反应,反应物不可能完全转化,由表中数据可知,压强和温度对平衡移动都有影响,增大压强SO2的转化率增大,但增大的幅度较小,升高温度SO2的转化率减小,说明该反应为放热反应,升高温度平衡向逆反应方向移动.
解答:
解:(1)该反应为可逆反应,反应物不可能完全转化,无论压强和温度怎样变化,SO2的转化率都不可能为100%,当正逆反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度,但改变外界条件下,平衡发生移动,
故答案为:可逆反应中的反应物不能全部转化成生成物;(或可逆反应中的逆反应速率与正反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度;或改变反应条件可以改变化学反应限度等);
(2)由表中数据可知,压强和温度对平衡移动都有影响,增大压强SO2的转化率增大,但增大的幅度较小,升高温度SO2的转化率减小,说明该反应为放热反应,升高温度平衡向逆反应方向移动,所以提高该化学反应限度的途径有增大压强或在一定范围内降低温度,
故答案为:增大压强或在一定范围内降低温度;
(3)虽然反应放热,升高温度不利于平衡向正反应方向移动,但考虑催化剂的活性和反应速率不能太低,一般选择的温度为500℃,在0.1MPa时,SO2的转化率已经很大,若增大压强,对设备会有更高的要求,工业生成中常在0.1MPa下进行反应,故答案为:温度为500℃,压强为0.1MPa.
故答案为:可逆反应中的反应物不能全部转化成生成物;(或可逆反应中的逆反应速率与正反应速率相等时,生成物和反应物的浓度不再改变,该反应就达到了一定的限度;或改变反应条件可以改变化学反应限度等);
(2)由表中数据可知,压强和温度对平衡移动都有影响,增大压强SO2的转化率增大,但增大的幅度较小,升高温度SO2的转化率减小,说明该反应为放热反应,升高温度平衡向逆反应方向移动,所以提高该化学反应限度的途径有增大压强或在一定范围内降低温度,
故答案为:增大压强或在一定范围内降低温度;
(3)虽然反应放热,升高温度不利于平衡向正反应方向移动,但考虑催化剂的活性和反应速率不能太低,一般选择的温度为500℃,在0.1MPa时,SO2的转化率已经很大,若增大压强,对设备会有更高的要求,工业生成中常在0.1MPa下进行反应,故答案为:温度为500℃,压强为0.1MPa.
点评:本题考查化学平衡的影响因素,题目难度不大,注意分析表中数据,注重基础知识的积累.

练习册系列答案
相关题目
下列根据实验现象所得出的结论一定正确的是( )
| A、某无色溶液滴加酚酞试液后显红色,结论:该溶液中一定含OH- |
| B、某无色溶液加入盐酸产生无色无味气体,结论:溶液中一定含有CO32- |
| C、某气体能使品红溶液褪色,结论:该气体为SO2气体 |
| D、向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液,出现白色沉淀,结论:溶液X中一定含有SO42- |
某些芳香族化合物的分子式均为C7H8O,其中液态时能与金属Na反应产生H2和不反应产生H2的结构分别有( )
| A、2种和1种 |
| B、2种和3种 |
| C、3种和2种 |
| D、4种和1种 |
能在有机物的分子中引入羟基的反应类型有:①酯化反应;②取代反应;③消去反应;④加成反应;⑤水解反应;⑥还原反应.其中正确的组合有( )
| A、①②③ | B、②④⑤ |
| C、②④⑤⑥ | D、②③④⑤⑥ |
下列各实验装置图与操作正确且能达到实验目的是( )

| A、待KNO3热饱和溶液冷却 |
| B、用工业酒精制取无水乙醇结晶后进行快速过滤 |
| C、实验室收集SO2气体 |
| D、实验室干燥氨气 |