题目内容
5.下列实验对应的现象及结论均正确且两者具有因果关系的是( )| 选项 | 实验 | 现象 | 结论 |
| A | 25℃,两片相同的Al片分别和等体积稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
| B | 将无水乙醇和浓H2SO4的混合物加热至170℃,产生的气体通入酸性KMnO4溶液 | KMnO4溶液紫红色褪去 | 乙烯具有还原性 |
| C | SO2通入BaCl2溶液,然后滴入稀硝酸 | 有白色沉淀产生,加入稀硝酸后沉淀不溶解 | 所得沉淀为BaSO3,后转化为BaSO4 |
| D | 向盛有AgCl固体试管中加入一定量的0.01mol•L-1 KI溶液 | 固体由白色逐渐变为黄色 | Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.25℃,Al与浓硝酸发生钝化;
B.乙醇易挥发,乙醇与生成的乙烯均可被高锰酸钾氧化;
C.SO2通入BaCl2溶液,不反应;
D.发生沉淀的转化.
解答 解:A.25℃,Al与浓硝酸发生钝化,现象、结论均不合理,故A错误;
B.乙醇易挥发,乙醇与生成的乙烯均可被高锰酸钾氧化,则不能说明乙烯具有还原性,故B错误;
C.SO2通入BaCl2溶液,不反应,不生成白色沉淀,后加稀硝酸发生氧化还原反应生成硫酸钡沉淀,故C错误;
D.由操作和现象可知发生沉淀的转化,可知Ksp(AgCl)>Ksp(AgI),故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象、沉淀转化等为解答关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
16.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | 3Cl2+6FeI2═4FeI3+2FeCl3 | B. | 3Cl2+2FeI2═2FeCl3+2I2 | ||
| C. | Co2O3+6HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
13.设NA为阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 标准状况下,224 mL水中含有的电子数为0.1NA | |
| B. | 44 g由N2O和CO2组成的混合气体中含有的原子数为3NA | |
| C. | 将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,所得胶粒数目为0.01NA | |
| D. | 在反应:KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3mol Cl2,转移的电子数为6NA |
20.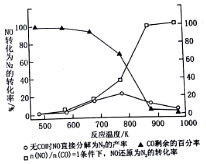 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
请回答下列问题:
(1)将一定量的某利M2.5样品用蒸馏水溶解制成待测试样(忽略OH-).常温下测得该训试样的组成及其浓度如表一:根据表一中数据判断该试样的pH=4.
表一:
(2)汽车尾气中NOx和CO的生成:①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是D.
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1:1:2D.氧气的转化率不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.下列可作为洗涤含SO2的烟气的洗涤剂的是AB.
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示.若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为NO的分解反应是放热反应,升温有利于反应逆向进行,在$\frac{n(NO)}{n(CO)}$=1的条件下,为更好的除去NOx物质,应控制的最佳温度在870K左右.
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
①写出NO与活性炭反应的化学方程式C+2NO?N2+CO2,②若T1<T2,则该反应的△H<O (填”>”、“<”或“=”).
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%.
 雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.
雾霾天气严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染.请回答下列问题:
(1)将一定量的某利M2.5样品用蒸馏水溶解制成待测试样(忽略OH-).常温下测得该训试样的组成及其浓度如表一:根据表一中数据判断该试样的pH=4.
表一:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1:1:2D.氧气的转化率不再变化
(3)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5KJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②洗涤含SO2的烟气.下列可作为洗涤含SO2的烟气的洗涤剂的是AB.
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示.若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为NO的分解反应是放热反应,升温有利于反应逆向进行,在$\frac{n(NO)}{n(CO)}$=1的条件下,为更好的除去NOx物质,应控制的最佳温度在870K左右.
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表二:
表二:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%.
10.化学与生活、能源、环科技等密切相关.下列描述错误的是( )
| A. | 在厨房里用米汤不能直接检验食盐中是否含有碘 | |
| B. | 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
17.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 铝及其合金是生活中广泛使用的材料,通常用电解氯化铝的方法制取 | |
| B. | 采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量 | |
| C. | 偏二甲肼[NH2N(CH3)2]是一种液体燃料,它的一种同分异构体可以是氨基酸 | |
| D. | 邻苯二甲酸二辛酯常用作增塑剂,对人体无害,可用作食品添加剂 |
14.短周期元素W、X、Y、Z的原子序数依次增加,Y和W、Y和Z分别相邻,且W、Y和Z三种元素的原子最外层电子数之和为19,X原子的电子层数与最外层电子数相等,下列说法错误的是( )
| A. | 单质的沸点:Y>W>Z | B. | 离子半径:X<Y | ||
| C. | 气态氢化物的稳定性:W>Y | D. | W与X可形成离子化合物 |
9.在下列结构的有机化合物中①CH3-CH2-CH2-CH2-CH3
②CH3-CH2-CH2-CH2-CH2-CH3
③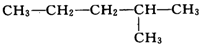
④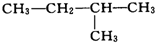
⑤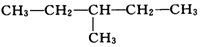
属于同分异构体的是( )
②CH3-CH2-CH2-CH2-CH2-CH3
③
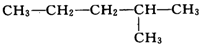
④
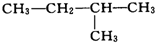
⑤

属于同分异构体的是( )
| A. | ①②和④ | B. | ②③和⑤ | C. | ①和② | D. | ④和③ |