题目内容
13.X、Y、M、N四种相邻主族短周期元素的相对位置如下表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.| M | N | ||
| X | Y |
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为
 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
分析 X、Y、M、N四种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,M和N位于第二周期、X和Y位于第三周期,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性,则Y是Al元素,根据元素位置知,X是Mg元素、M是C元素、N元素N元素,再结合题目分析解答.
解答 解:X、Y、M、N四种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,M和N位于第二周期、X和Y位于第三周期,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性,则Y是Al元素,根据元素位置知,X是Mg元素、M是C元素、N元素N元素;
(1)元素Y是Al元素,在周期表中的位置是第三周期第IIIA族,其单质可以采用电解熔融Al2O3的方法制备,
故答案为:第三周期第ⅢA族;Al2O3;
(2)M、N、Y分别是C、N、Al,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这三种元素中非金属性最强的是N元素,所以酸性最强的是HNO3,把过量的氨气通入氯化铝溶液中生成Al(OH)3白色沉淀;
故答案为:HNO3;产生白色沉淀;
(3)气体分子(MN)2为(CN)2,电子式为 ,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaCNO、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O;若还原性CN->I-,将适量的(CN)2、I2、KCN、KI在水中混合后,I2把KCN氧化为(CN)2,其反应离子方程式为:I2+2CN-=2I-+(CN)2;
,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaCNO、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O;若还原性CN->I-,将适量的(CN)2、I2、KCN、KI在水中混合后,I2把KCN氧化为(CN)2,其反应离子方程式为:I2+2CN-=2I-+(CN)2;
故答案为: ;2NaOH+(CN)2=NaCN+NaCNO+H2O;I2+2CN-=2I-+(CN)2.
;2NaOH+(CN)2=NaCN+NaCNO+H2O;I2+2CN-=2I-+(CN)2.
点评 本题考查了元素周期表和元素周期律的综合应用,根据元素在周期表中物质及元素性质确定元素,再结合物质的性质分析解答,采用知识迁移的方法分析解答(3)题,题目难度中等,侧重于考查学生的分析能力和对知识的迁移、应用能力.

| A. | 1和8 | B. | 6和8 | C. | 16和8 | D. | 12和17 |
| A. | HCl气体溶于水 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | 碘升华 |
| A. | NaCl和KNO3 | B. | BaCO3和MnO2 | C. | CaCO3和Na2CO3 | D. | KOH和NaNO3 |
| A. | NH4I的电子式: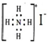 | |
| B. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| C. | 钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比不同 | |
| D. | Al2O3的化学键类型与AlCl3的化学键类型相同 |
| A. | 一种金属元素和一种非金属元素一定能形成离子化合物 | |
| B. | 离子键只存在于离子化合物中 | |
| C. | 共价键只存在于共价化合物中 | |
| D. | 离子化合物中必定含有金属元素 |
| A. | 氢有三种同位素,即有三种氢原子 | |
| B. | 所有元素的原子核均由质子和中子构成 | |
| C. | 具有相同核外电子数的粒子总称为元素 | |
| D. | 相对原子质量相同的原子是同一种元素的原子 |
 ;写出结构式:CO2O=C=O.
;写出结构式:CO2O=C=O.