题目内容
8.化学科学需要借助化学语言来描述,下列化学用语正确的是( )| A. | NH4I的电子式: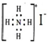 | |
| B. | Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱 | |
| C. | 钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比不同 | |
| D. | Al2O3的化学键类型与AlCl3的化学键类型相同 |
分析 A.阴离子电子式书写错误;
B.Na2SiO3溶液与SO3的反应,为强酸制取弱酸的反应,可知硫酸酸性大于硅酸;
C.钠、锂分别在空气中燃烧,分别得到Na2O2、Li2O;
D.Al2O3含离子键,AlCl3含共价键.
解答 解:A.NH4I的电子式: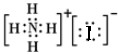 ,故A错误;
,故A错误;
B.Na2SiO3溶液与SO3的反应,为强酸制取弱酸的反应,可知硫酸酸性大于硅酸,则可用于推断Si与S的非金属性强弱,故B正确;
C.钠、锂分别在空气中燃烧,分别得到Na2O2、Li2O,则生成的氧化物中阴阳离子数目比均为1:2,故C错误;
D.Al2O3含离子键,AlCl3含共价键,则化学键不同,故D错误;
故选B.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意物质中的化学键判断,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
18.关于卤素的下列叙述正确的是( )
| A. | 卤素是典型的非金属元素,因此不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其熔、沸点就越高 | |
| C. | 卤素单质都能和水剧烈反应 | |
| D. | 卤素单质都能和H2反应,且气态氢化物的稳定性随单质氧化性的增强而增强 |
19.榄香烯是一种新型的抗癌药,它的结构简式如图,有关说法正确的是( )
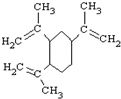

| A. | 榄香烯的分子式为C15H20 | |
| B. | 榄香烯属于芳香烃 | |
| C. | 榄香烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色 | |
| D. | 1mol榄香烯最多能和3molH2反应 |
3.某有机物的结构简式为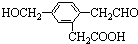 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )
①加成 ②水解 ③取代 ④氧化 ⑤还原 ⑥消去.
 ,它在一定条件下可能发生的反应有( )
,它在一定条件下可能发生的反应有( )①加成 ②水解 ③取代 ④氧化 ⑤还原 ⑥消去.
| A. | ②③④ | B. | ①③⑤⑥ | C. | ①③④⑤ | D. | ①③④⑤⑥ |
13.X、Y、M、N四种相邻主族短周期元素的相对位置如下表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.
注意:用化学式回答下列问题(不要以字母代替)
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
| M | N | ||
| X | Y |
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为
 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
20.NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| C. | 标准状况下,11.2L18O2中所含中子数为8NA | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
17.现有甲乙丙丁四种物质,分别由2种或3种元素组成,它们的分子都具有与氩(Ar)相同的电子数.其中乙与NaOH液反应可生成两种盐,两种盐的水溶液均显碱性.下列推断合理的是( )
| A. | 乙可能由3种元素组成 | |
| B. | 若甲与乙中各元素质量比相同,则甲中一定含有氧元素 | |
| C. | 丙中一种元素原子的最外层电子数是内层电子总数的2倍,则丙一定是甲烷的同系物 | |
| D. | 若丁中为双原子分子,则丁中含有的化学键一定是极性键 |
18.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O;
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
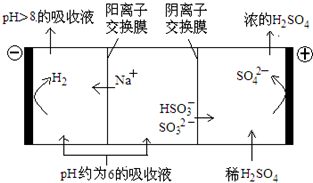
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O;
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.