题目内容
5.写出电子式:KCl ;写出结构式:CO2O=C=O.
;写出结构式:CO2O=C=O.
分析 氯化钾为离子化合物,电子式中需要标出阴阳离子所带电荷;CO2为直线形分子.
解答 解:KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ;CO2为直线形分子,其结构式为O=C=O;
;CO2为直线形分子,其结构式为O=C=O;
故答案为: ;O=C=O.
;O=C=O.
点评 本题考查了电子式和结构式的书写,题目难度不大,注意离子化合物与共价化合物的电子式的表示方法及区别,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
15.下列变化的实质相似的是
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
②浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
③二氧化硫能使品红溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸用铁的容器存放、加热条件下浓硫酸能与木炭反应( )
| A. | 只有②③④ | B. | 只有⑤ | C. | 只有③④ | D. | 全部 |
13.X、Y、M、N四种相邻主族短周期元素的相对位置如下表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.
注意:用化学式回答下列问题(不要以字母代替)
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为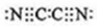 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
| M | N | ||
| X | Y |
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为
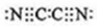 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
20.NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 1.0L1.0mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温下,0.1mol碳酸钠晶体中含有CO32-的个数为0.1NA | |
| C. | 标准状况下,11.2L18O2中所含中子数为8NA | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA |
17.现有甲乙丙丁四种物质,分别由2种或3种元素组成,它们的分子都具有与氩(Ar)相同的电子数.其中乙与NaOH液反应可生成两种盐,两种盐的水溶液均显碱性.下列推断合理的是( )
| A. | 乙可能由3种元素组成 | |
| B. | 若甲与乙中各元素质量比相同,则甲中一定含有氧元素 | |
| C. | 丙中一种元素原子的最外层电子数是内层电子总数的2倍,则丙一定是甲烷的同系物 | |
| D. | 若丁中为双原子分子,则丁中含有的化学键一定是极性键 |
14.在下列实验中,实验操作与现象一致的是( )
| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
15.下列实验能达到预期目的是( )
| A. | 验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液 | |
| C. | 向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解 | |
| D. | 除去苯中混有的少量苯酚,加入浓溴水后过滤 |

 .
.