题目内容
3.下列叙述中,正确的是( )| A. | 氢有三种同位素,即有三种氢原子 | |
| B. | 所有元素的原子核均由质子和中子构成 | |
| C. | 具有相同核外电子数的粒子总称为元素 | |
| D. | 相对原子质量相同的原子是同一种元素的原子 |
分析 A、氢有氕、氘、氚三种核素,每一种核素代表一种原子;
B、氕只有质子数,不含中子数;
C、具有相同质子数的一类原子称为元素;
D、元素的种类由质子数决定.
解答 解:A、氢有氕、氘、氚三种核素,每一种核素代表一种氢原子,故A正确;
B、氕只有质子数,不含中子数,故B错误;
C、具有相同质子数的一类原子称为元素,核外电子数相同不一定属于同种元素,如Ne和Na+,故C错误;
D、具有相同质子数的原子是同一种元素的原子,故D错误;
故选:A.
点评 本题考查了核素、元素、同位素的定义,题目难度不大,注意把握定义和掌握一些特殊例子是解题的关键.

练习册系列答案
相关题目
13.X、Y、M、N四种相邻主族短周期元素的相对位置如下表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.
注意:用化学式回答下列问题(不要以字母代替)
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为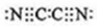 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
| M | N | ||
| X | Y |
(1)元素Y在周期表中的位置是第三周期第ⅢA族,其单质可采用电解熔融Al2O3的方法制备.
(2)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,将过量的N形成的最常见氢化物通入到Y的氯化物溶液中,产生的现象是产生白色沉淀.
(3)气体分子(MN)2的电子式为
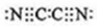 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
14.在下列实验中,实验操作与现象一致的是( )
| 选项 | 实验操作 | 实验现象 |
| A | 将钠加入到硫酸铜溶液中 | 有气泡冒出,有红色固体析出 |
| B | 将足量过氧化氢加入到硫酸亚铁溶液中 | 无明显变化 |
| C | 将过氧化钠投入氯化亚铁溶液中 | 最终生成红褐色沉淀 |
| D | 将氢氧化钠溶液逐滴滴入氯化亚铁溶液中 | 立即产生红褐色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
18.直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O;
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①上表判断NaHSO3溶液显酸性,用化学平衡原理解释HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
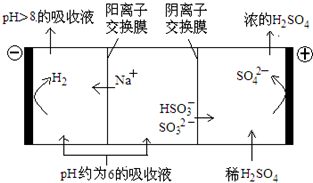
①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:SO2+H2O?H2SO3、2H2SO3+O2=2H2SO4;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O;
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab;
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:

①HSO3-在阳极放电的电极反应式是HSO3-+H2O-2e-=SO42-+3H+;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
8.下列说法不正确的是( )
| A. | 电解质在融化状态下一定导电 | |
| B. | 常温下反应NH3(g)+HCl(g)=NH4Cl(s)能进行,则△H<0 | |
| C. | 常温下等pH的强酸HA和弱酸HB的两种溶液中,是的电离同等程度被抑制 | |
| D. | 恒温密闭容器中充入一定量的A进行反应:3A(g)?B(g)+2C(g),达到平衡后,在其它条件不变情况下,再充入一定量的A气体,A的转化率将不变 |
15.下列实验能达到预期目的是( )
| A. | 验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 检验溴乙烷中溴元素时,将溴乙烷和NaOH溶液混合,充分振荡静置后加AgNO3溶液 | |
| C. | 向淀粉溶液中加稀硫酸加热后,加NaOH中和并做银镜反应,检验淀粉是否水解 | |
| D. | 除去苯中混有的少量苯酚,加入浓溴水后过滤 |
12.根据陈述的知识,类推得出的结论正确的是( )
| A. | 钠在空气中燃烧生成的氧化物是Na2O2,则锂在空气中燃烧生成的氧化物是Li2O2 | |
| B. | NH3和PCl3是等电子体,均为三角锥形结构 | |
| C. | CO2和SiO2 化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | 第二周期元素氢化物稳定性顺序是HF>H2O>NH3;则第三周期元素氢化物稳定性顺序也是HCl>H2S>PH3 |
13.常温下,0.10mol/L的下列溶液中呈中性的是( )
| A. | 氨水 | B. | NaNO3溶液 | C. | 盐酸 | D. | Na2CO3溶液 |
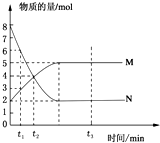 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示: